Calore specifico di vaporizzazione dell'acqua in kcal. Calore specifico di vaporizzazione
Tutti sanno che l'acqua nel bollitore bolle ad una temperatura di 100°C. Ma hai notato che la temperatura dell'acqua non cambia durante il processo di ebollizione? La domanda è: dove va a finire l’energia generata se teniamo costantemente il contenitore in fiamme? Serve a convertire il liquido in vapore. Pertanto, affinché l'acqua si trasformi allo stato gassoso, è necessaria una fornitura costante di calore. La quantità necessaria per convertire un chilogrammo di liquido in vapore alla stessa temperatura è determinata da una quantità fisica chiamata calore specifico di vaporizzazione dell'acqua.
Significato fisico della grandezza
L'ebollizione richiede energia. La maggior parte viene utilizzata per lo strappo legami chimici tra atomi e molecole, a seguito delle quali si formano bolle di vapore, e quella più piccola va ad espandere il vapore, cioè in modo che le bolle risultanti possano scoppiare e rilasciarlo. Poiché il liquido impiega tutta la sua energia per passare allo stato gassoso, le sue “forze” si esauriscono. Per rinnovare costantemente l'energia e prolungare l'ebollizione, è necessario fornire sempre più calore al contenitore con il liquido. Una caldaia, un bruciatore a gas o qualsiasi altro dispositivo di riscaldamento può fornire la sua alimentazione. Durante l'ebollizione la temperatura del liquido non aumenta; alla stessa temperatura si forma vapore.
Richiedono liquidi diversi quantità diverse calore per trasformarsi in vapore. Quale è mostrato dal calore specifico di vaporizzazione.
Puoi capire come viene determinato questo valore da un esempio. Prendi 1 litro d'acqua e portala a ebollizione. Successivamente misuriamo la quantità di calore necessaria per far evaporare tutto il liquido e otteniamo il valore del calore specifico di vaporizzazione dell'acqua. Per altri composti chimici questa cifra sarà diversa.
In fisica si indica il calore specifico di vaporizzazione Lettera latina L. Si misura in joule per chilogrammo (J/kg). Può essere ricavato dividendo il calore speso per l'evaporazione per la massa del liquido:
Questo valore è molto importante per i processi produttivi basati sulle moderne tecnologie. Ad esempio, si concentrano su di esso nella produzione di metalli. Si è scoperto che se il ferro viene fuso e poi condensato, dopo un ulteriore indurimento si forma un materiale più resistente. reticolo cristallino.
A cosa è uguale
Potere calorifico specifico per varie sostanze(r) determinato durante le prove di laboratorio. L'acqua alla normale pressione atmosferica bolle a 100 °C e il calore di evaporazione dell'acqua è 2258,2 kJ/kg. Questo indicatore per alcune altre sostanze è riportato nella tabella:
| Sostanza | punto di ebollizione, °C | r, kJ/kg |
|---|---|---|
| Azoto | -196 | 198 |
| Elio | -268,94 | 20,6 |
| Idrogeno | -253 | 454 |
| Ossigeno | -183 | 213 |
| Carbonio | 4350 | 50000 |
| Fosforo | 280 | 400 |
| Metano | -162 | 510 |
| Pentano | 36 | 360 |
| Ferro | 2735 | 6340 |
| Rame | 2590 | 4790 |
| Stagno | 2430 | 2450 |
| Guida | 1750 | 8600 |
| Zinco | 907 | 1755 |
| Mercurio | 357 | 285 |
| Oro | 2 700 | 1 650 |
| Etanolo | 78 | 840 |
| Alcool metilico | 65 | 1100 |
| Cloroformio | 61 | 279 |
Tuttavia, questo indicatore può cambiare sotto l'influenza di alcuni fattori:
- Temperatura. All'aumentare del calore di evaporazione diminuisce e può essere pari a zero.
t, °C r, kJ/kg 2500 10 2477 20 2453 50 2380 80 2308 100 2258 200 1940 300 1405 374 115 374,15 - Pressione. Al diminuire della pressione aumenta il calore di vaporizzazione e viceversa. Il punto di ebollizione è direttamente proporzionale alla pressione e può raggiungere il valore critico di 374 °C.
p, Pa t bollire., °C r, kJ/kg 0,0123 10 2477 0,1234 50 2380 1 100 2258 2 120 2202 5 152 2014 10 180 1889 20 112 1638 50 264 1638 100 311 1316 200 366 585 220 373,7 184,8 Critico 221.29 374,15 - - Massa della sostanza. La quantità di calore coinvolta nel processo è direttamente proporzionale alla massa di vapore formato.
Relazione tra evaporazione e condensazione
I fisici hanno scoperto che il processo opposto all'evaporazione, la condensazione, è che il vapore consuma esattamente la stessa quantità di energia utilizzata per formarlo. Questa osservazione conferma la legge di conservazione dell’energia.
Altrimenti sarebbe possibile realizzare un impianto in cui il liquido evaporerebbe e poi condenserebbe. La differenza tra il calore richiesto per l'evaporazione e il calore sufficiente per la condensazione comporterebbe un accumulo di energia che potrebbe essere utilizzata per altri scopi. In sostanza, verrebbe creata una macchina a moto perpetuo. Ma questo contraddice le leggi fisiche, il che significa che è impossibile.
Come viene misurato?
- Calore specifico L'evaporazione dell'acqua viene misurata sperimentalmente nei laboratori fisici. A questo scopo vengono utilizzati i calorimetri. La procedura è simile alla seguente:
- Una certa quantità di liquido viene versata nel calorimetro.
In questa lezione presteremo attenzione a questo tipo di evaporazione, come l'ebollizione, discuteremo le sue differenze rispetto al processo di evaporazione discusso in precedenza, introdurremo un valore come la temperatura di ebollizione e discuteremo da cosa dipende. Alla fine della lezione introdurremo una quantità molto importante che descrive il processo di vaporizzazione: il calore specifico di vaporizzazione e condensazione.
Argomento: Stati aggregati della materia
Lezione: ebollizione. Calore specifico di vaporizzazione e condensazione
Nell'ultima lezione abbiamo già esaminato uno dei tipi di formazione del vapore - l'evaporazione - e evidenziato le proprietà di questo processo. Oggi parleremo di questo tipo di vaporizzazione, il processo di ebollizione, e introdurremo un valore che caratterizza numericamente il processo di vaporizzazione: il calore specifico di vaporizzazione e condensazione.
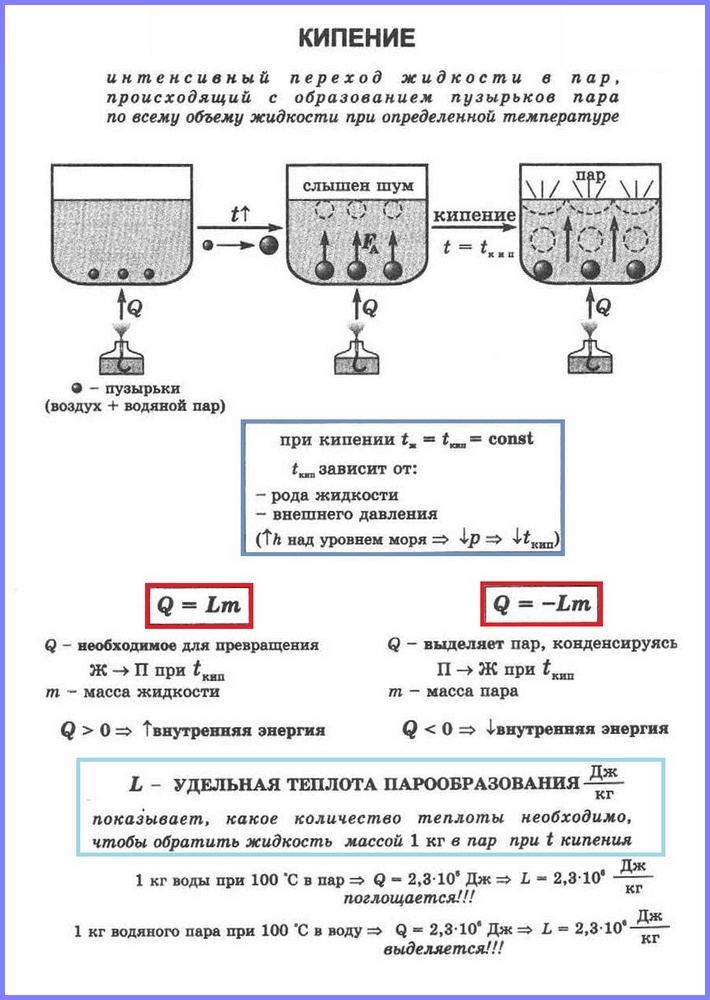
Definizione.Bollente(Fig. 1) è un processo di intensa transizione di un liquido allo stato gassoso, accompagnato dalla formazione di bolle di vapore e che si verifica in tutto il volume del liquido ad una certa temperatura, chiamata punto di ebollizione.
Confrontiamo tra loro i due tipi di vaporizzazione. Il processo di ebollizione è più intenso del processo di evaporazione. Inoltre, come ricordiamo, il processo di evaporazione avviene a qualsiasi temperatura superiore al punto di fusione e il processo di ebollizione rigorosamente a una certa temperatura, che è diversa per ciascuna sostanza ed è chiamata punto di ebollizione. Va inoltre notato che l'evaporazione avviene solo dalla superficie libera del liquido, cioè dall'area che lo separa dai gas circostanti, e l'ebollizione avviene contemporaneamente dall'intero volume.
Diamo un'occhiata al processo di ebollizione in modo più dettagliato. Immaginiamo una situazione che molti di noi hanno riscontrato più volte: riscaldare e far bollire l'acqua in una nave, ad esempio una casseruola. Durante il riscaldamento, una certa quantità di calore verrà trasferita all'acqua, il che porterà ad un aumento della sua energia interna e ad un aumento dell'attività del movimento molecolare. Questo processo continuerà fino a quando certa fase fino a quando l'energia del movimento molecolare diventa sufficiente per iniziare l'ebollizione.
L'acqua contiene gas disciolti (o altre impurità) che vengono rilasciati nella sua struttura, il che porta alla cosiddetta formazione di centri di vaporizzazione. Cioè, è in questi centri che il vapore inizia a essere rilasciato e si formano bolle in tutto il volume dell'acqua, che si osservano durante l'ebollizione. È importante capire che queste bolle non contengono aria, ma vapore che si forma durante il processo di ebollizione. Dopo la formazione delle bolle, la quantità di vapore al loro interno aumenta e iniziano ad aumentare di dimensioni. Spesso le bolle si formano inizialmente vicino alle pareti del vaso e non salgono immediatamente in superficie; dapprima, aumentando di dimensioni, risentono della forza crescente di Archimede, quindi si staccano dal muro e salgono in superficie, dove scoppiano e rilasciano una porzione di vapore.
Vale la pena notare che non tutte le bolle di vapore raggiungono immediatamente la superficie libera dell'acqua. All'inizio del processo di ebollizione, l'acqua non è ancora riscaldata in modo uniforme e gli strati inferiori, in prossimità dei quali avviene direttamente il processo di trasferimento del calore, sono ancora più caldi di quelli superiori, anche tenendo conto del processo di convezione. Ciò fa sì che le bolle di vapore che salgono dal basso collassano per il fenomeno della tensione superficiale, prima di raggiungere la superficie libera dell'acqua. In questo caso, il vapore che era all'interno delle bolle passa nell'acqua, riscaldandola ulteriormente e accelerando il processo di riscaldamento uniforme dell'acqua in tutto il volume. Di conseguenza, quando l'acqua si riscalda in modo quasi uniforme, quasi tutte le bolle di vapore iniziano a raggiungere la superficie dell'acqua e inizia il processo di intensa formazione di vapore.
È importante evidenziare il fatto che la temperatura alla quale avviene il processo di ebollizione rimane invariata anche se aumenta l'intensità dell'apporto di calore al liquido. In parole semplici, se durante il processo di ebollizione si aggiunge gas su un bruciatore che riscalda una pentola d'acqua, ciò comporterà solo un aumento dell'intensità dell'ebollizione e non un aumento della temperatura del liquido. Se approfondiamo più seriamente il processo di ebollizione, vale la pena notare che nell'acqua compaiono aree in cui può surriscaldarsi al di sopra del punto di ebollizione, ma la quantità di tale surriscaldamento, di regola, non supera uno o un paio di gradi ed è insignificante nel volume totale del liquido. Punto di ebollizione dell'acqua a pressione normaleè 100°C.
Durante il processo di ebollizione dell'acqua, puoi notare che è accompagnato da suoni caratteristici del cosiddetto ribollire. Questi suoni sorgono proprio a causa del processo descritto di collasso delle bolle di vapore.
I processi di ebollizione di altri liquidi procedono allo stesso modo dell'ebollizione dell'acqua. La differenza principale in questi processi sono le diverse temperature di ebollizione delle sostanze, che alla normale pressione atmosferica sono già valori tabellari misurati. Indichiamo in tabella i valori principali di queste temperature.
Un fatto interessante è che il punto di ebollizione dei liquidi dipende dal valore pressione atmosferica, motivo per cui abbiamo indicato che tutti i valori nella tabella sono forniti alla normale pressione atmosferica. Quando la pressione dell'aria aumenta, aumenta anche il punto di ebollizione del liquido; quando diminuisce, al contrario, diminuisce.
Su questa dipendenza della temperatura di ebollizione dalla pressione ambiente basato sul principio di funzionamento di un noto elettrodomestico da cucina come la pentola a pressione (Fig. 2). È una padella con un coperchio aderente, sotto il quale, durante il processo di cottura a vapore dell'acqua, la pressione dell'aria con vapore raggiunge fino a 2 pressione atmosferica, che porta ad un aumento del punto di ebollizione dell'acqua al suo interno fino a . Per questo motivo, l'acqua e il cibo in esso contenuti hanno l'opportunità di riscaldarsi a una temperatura superiore al normale () e il processo di cottura viene accelerato. A causa di questo effetto, il dispositivo ha preso il nome.

Riso. 2. Pentola a pressione ()
Anche la situazione con una diminuzione del punto di ebollizione di un liquido con una diminuzione della pressione atmosferica ha un esempio dalla vita, ma per molte persone non è più quotidiana. Questo esempio vale per gli spostamenti degli alpinisti in zone di alta montagna. Si scopre che nelle aree situate ad un'altitudine di 3000-5000 m, il punto di ebollizione dell'acqua a causa di una diminuzione della pressione atmosferica si riduce a valori più bassi, il che porta a difficoltà nella preparazione del cibo durante le escursioni, perché per un trattamento termico efficace di prodotti in In questo caso, significativi tempo più lungo che in condizioni normali. Ad altitudini di circa 7000 m il punto di ebollizione dell'acqua raggiunge il , il che rende impossibile la cottura di molti prodotti in tali condizioni.
Alcune tecnologie per la separazione delle sostanze si basano sul fatto che i punti di ebollizione delle diverse sostanze sono diversi. Ad esempio, se consideriamo l'olio da riscaldamento, che è un liquido complesso costituito da molti componenti, durante il processo di ebollizione può essere suddiviso in diverse sostanze. In questo caso, poiché i punti di ebollizione del cherosene, della benzina, della nafta e dell'olio combustibile sono diversi, possono essere separati l'uno dall'altro mediante vaporizzazione e condensazione a temperature diverse. Questo processo è solitamente chiamato frazionamento (Fig. 3).

Riso. 3 Separazione dell'olio in frazioni ()
Come ogni processo fisico, l'ebollizione deve essere caratterizzata utilizzando un valore numerico, questo valore è chiamato calore specifico di vaporizzazione.
Per comprendere il significato fisico di questo valore, si consideri il seguente esempio: prendere 1 kg di acqua e portarlo al punto di ebollizione, quindi misurare quanto calore è necessario per far evaporare completamente quest'acqua (senza tenere conto delle perdite di calore) - questo valore sarà pari al calore specifico di vaporizzazione dell'acqua. Per un'altra sostanza, questo valore termico sarà diverso e sarà il calore specifico di vaporizzazione di questa sostanza.
Il calore specifico di vaporizzazione risulta essere una caratteristica molto importante nel tecnologie moderne produzione di metalli. Si scopre che, ad esempio, durante la fusione e l'evaporazione del ferro con successiva condensazione e solidificazione, si forma un reticolo cristallino con una struttura che fornisce una resistenza maggiore rispetto al campione originale.
Designazione: calore specifico di vaporizzazione e condensazione (a volte indicato con ).
Unità di misura: .
Il calore specifico di vaporizzazione delle sostanze viene determinato mediante esperimenti di laboratorio e i suoi valori per le sostanze base sono elencati nella tabella appropriata.
|
Sostanza |
Si chiama il fenomeno per cui una sostanza passa dallo stato liquido a quello gassoso vaporizzazione. La vaporizzazione può essere effettuata sotto forma di due processi: i.
Bollente
Il secondo processo di vaporizzazione è l'ebollizione. Questo processo può essere osservato utilizzando un semplice esperimento riscaldando l'acqua in una boccetta di vetro. Quando l'acqua viene riscaldata, dopo un po' compaiono delle bolle contenenti aria e vapore acqueo saturo, che si forma quando l'acqua evapora all'interno delle bolle. All'aumentare della temperatura, la pressione all'interno delle bolle aumenta e, sotto l'influenza della forza di galleggiamento, salgono verso l'alto. Tuttavia, poiché la temperatura degli strati superiori dell'acqua è inferiore a quella inferiore, il vapore nelle bolle inizia a condensarsi e queste si restringono. Quando l'acqua si riscalda per tutto il volume, le bolle di vapore salgono in superficie, scoppiano e il vapore fuoriesce. L'acqua sta bollendo. Ciò avviene ad una temperatura alla quale la pressione vapore saturo nelle bolle è uguale alla pressione atmosferica.
Viene chiamato il processo di vaporizzazione che avviene nell'intero volume di liquido ad una certa temperatura. Si chiama temperatura alla quale un liquido bolle punto di ebollizione.
Questa temperatura dipende dalla pressione atmosferica. All’aumentare della pressione atmosferica aumenta il punto di ebollizione.
L'esperienza dimostra che durante il processo di ebollizione la temperatura del liquido non cambia, nonostante l'energia provenga dall'esterno. La transizione del liquido allo stato gassoso al punto di ebollizione è associata ad un aumento della distanza tra le molecole e, di conseguenza, al superamento dell'attrazione tra di loro. L'energia fornita al liquido viene consumata per compiere lavoro atto a vincere le forze di attrazione. Ciò accade finché tutto il liquido non si trasforma in vapore. Poiché il liquido e il vapore hanno la stessa temperatura durante l'ebollizione, l'energia cinetica media delle molecole non cambia, aumenta solo la loro energia potenziale.
La figura mostra un grafico della dipendenza della temperatura dell'acqua dal tempo durante il suo riscaldamento temperatura ambiente al punto di ebollizione (AB), punto di ebollizione (BC), riscaldamento a vapore (CD), raffreddamento a vapore (DE), condensazione (EF) e successivo raffreddamento (FG).
Calore specifico di vaporizzazione
Per trasformare diverse sostanze dallo stato liquido a quello gassoso è necessaria un'energia diversa, questa energia è caratterizzata da un valore chiamato calore specifico di vaporizzazione.
Calore specifico di vaporizzazione (l) è un valore pari al rapporto tra la quantità di calore che deve essere impartita a una sostanza del peso di 1 kg per trasformarla dallo stato liquido allo stato gassoso al punto di ebollizione.
Unità di calore specifico di vaporizzazione - [ l] = J/kg.
Per calcolare la quantità di calore Q che deve essere impartita ad una sostanza di massa mn per la sua trasformazione dallo stato liquido a quello gassoso, si utilizza il calore specifico di vaporizzazione ( l) moltiplicato per la massa della sostanza: Q = Lm.
Quando il vapore condensa, viene rilasciata una certa quantità di calore, il cui valore è pari alla quantità di calore che deve essere spesa per convertire il liquido in vapore alla stessa temperatura.
Capacità termica specifica
Il calore specifico è la quantità di calore in Joule (J) necessaria per aumentare la temperatura di una sostanza. La capacità termica specifica è una funzione della temperatura. Per i gas è necessario distinguere tra capacità termica specifica a pressione costante e a volume costante.
Calore specifico di fusione
Il calore specifico di fusione di un solido è la quantità di calore in J necessaria per trasformare 1 kg di sostanza da solido a liquido nel suo punto di fusione.
Calore latente di vaporizzazione
Il calore latente di vaporizzazione di un liquido è la quantità di calore in J necessaria per far evaporare 1 kg di liquido al suo punto di ebollizione. Il calore latente della vaporizzazione dipende fortemente dalla pressione. Esempio: se viene applicato calore a un contenitore contenente 1 kg di acqua a 100°C (livello del mare), l'acqua assorbirà 1023 kJ di calore latente senza alcuna variazione nella lettura del termometro. Tuttavia, ci sarà un cambiamento nello stato di aggregazione da liquido a vapore. Il calore assorbito dall'acqua è chiamato calore latente di vaporizzazione.
Il vapore tratterrà 1023 kJ, poiché questa energia è stata necessaria per modificare lo stato di aggregazione.
Calore latente di condensazione
Nel processo inverso, quando viene rimosso il calore da 1 kg di vapore acqueo a 100°C (a livello del mare), il vapore rilascerà 1023 kJ di calore senza modificare la lettura del termometro. Tuttavia, ci sarà un cambiamento nello stato di aggregazione da vapore a liquido. Il calore assorbito dall’acqua è chiamato calore latente di condensazione.

Temperatura e pressione
Misure termiche La temperatura, o INTENSITÀ del calore, si misura con un termometro. La maggior parte delle temperature presenti in questo manuale sono espresse in gradi Celsius (C), ma a volte vengono utilizzati i gradi Fahrenheit (F). ed è trattenuto dalla gravità. Al livello del mare la pressione atmosferica è 1,0 bar e il punto di ebollizione dell'acqua è 100°C.
In qualsiasi punto sopra il livello del mare la pressione atmosferica è più bassa, così come il punto di ebollizione dell'acqua. Quando la pressione scende a 0,38 bar, il punto di ebollizione dell'acqua è 75°C, mentre ad una pressione di 0,12 bar è 50°C.
Se il punto di ebollizione dell'acqua viene influenzato da una diminuzione della pressione, è logico supporre che anche un aumento della pressione lo influenzerà. Un esempio è una caldaia a vapore!
Informazioni aggiuntive: Come convertire Fahrenheit in Celsius e viceversa: C = 5/9 × (F – 32). F = (9/5 × C)+32.
Kelvin = C + 273. Rankine = F + 460.
Questa conoscenza scompare rapidamente e gradualmente le persone smettono di prestare attenzione all'essenza dei fenomeni familiari. A volte è utile richiamare le conoscenze teoriche.
Definizione
Cosa sta bollendo? Si tratta di un processo fisico durante il quale avviene un'intensa vaporizzazione sia sulla superficie libera del liquido che all'interno della sua struttura. Uno dei segni dell'ebollizione è la formazione di bolle, costituite da vapore saturo e aria.
- Vale la pena notare l'esistenza di qualcosa come il punto di ebollizione. La velocità di formazione del vapore dipende anche dalla pressione. Deve essere permanente. In generale, la caratteristica principale dei prodotti chimici liquidi è il loro punto di ebollizione alla normale pressione atmosferica. Tuttavia, questo processo può essere influenzato anche da fattori come l’intensità delle onde sonore e la ionizzazione dell’aria.
- Fasi di ebollizione dell'acqua
- Il vapore inizierà sicuramente a formarsi durante una procedura come il riscaldamento. L'ebollizione prevede il passaggio del liquido attraverso 4 fasi: Piccole bolle iniziano a formarsi sul fondo della nave, così come sulle sue pareti. Ciò è dovuto al fatto che le crepe nel materiale di cui è composto il contenitore contengono aria, che si espande sotto l'influenza dell'alta temperatura. Le bolle iniziano ad aumentare di volume, facendole esplodere sulla superficie dell'acqua. Se lo strato superiore del liquido non ha ancora raggiunto il punto di ebollizione, le cavità scendono verso il basso, dopodiché ricominciano a tendere verso l'alto. Questo processo porta alla formazione di onde sonore. Ecco perché possiamo sentire il rumore quando l'acqua bolle.
- Si osserva un intenso ribollimento, accompagnato dalla formazione di grandi bolle che scoppiano rapidamente. Questo processo è accompagnato dalla comparsa di spruzzi e da un'intensa formazione di vapore.

Calore specifico di vaporizzazione
Quasi ogni giorno incontriamo un fenomeno come l'ebollizione. Il calore specifico di vaporizzazione è quantità fisica, che determina la quantità di calore. Con il suo aiuto, una sostanza liquida può essere trasformata in vapore. Per calcolare questo parametro è necessario dividere il calore di evaporazione per la massa.
Come avviene la misurazione?
L'indicatore specifico viene misurato in condizioni di laboratorio conducendo esperimenti appropriati. Includono quanto segue:
- misurato quantità richiesta liquido, che viene poi versato nel calorimetro;
- viene effettuata una prima misurazione della temperatura dell'acqua;
- sul bruciatore viene installato un pallone contenente la sostanza in esame precedentemente collocata;
- il vapore liberato dalla sostanza in esame viene lanciato nel calorimetro;
- la temperatura dell'acqua viene rimisurata;
- Viene pesato il calorimetro, che consente di calcolare la massa di vapore condensato.

Modalità di ebollizione delle bolle
Quando si affronta la questione di cosa sia l'ebollizione, vale la pena notare che ha diverse modalità. Quindi, quando riscaldato, il vapore può formarsi sotto forma di bolle. Periodicamente crescono e scoppiano. Questo regime di ebollizione è chiamato ebollizione nucleata. Tipicamente, le cavità riempite di vapore si formano proprio sulle pareti del recipiente. Ciò è dovuto al fatto che di solito sono surriscaldati. Questo condizione necessaria per la bollitura, altrimenti le bolle collasseranno senza raggiungere grandi dimensioni.

Modalità di ebollizione della pellicola
Cosa sta bollendo? Il modo più semplice per spiegare questo processo è la vaporizzazione ad una certa temperatura e pressione costante. Oltre alla modalità bolla, esiste anche la modalità film. La sua essenza sta nel fatto che quando il flusso di calore aumenta, le singole bolle si uniscono per formare uno strato di vapore sulle pareti della nave. Quando viene raggiunto un indicatore critico, sfondano la superficie dell'acqua. Questa modalità di ebollizione è diversa in quanto il grado di trasferimento di calore dalle pareti del recipiente al liquido stesso è significativamente ridotto. La ragione di ciò è lo stesso film di vapore.
Punto di ebollizione
Vale la pena notare che esiste una dipendenza del punto di ebollizione dalla pressione esercitata sulla superficie del liquido riscaldato. Pertanto, è generalmente accettato che l'acqua bolle quando viene riscaldata a 100 gradi Celsius. Tuttavia, questo indicatore può essere considerato corretto solo se la pressione atmosferica è considerata normale (101 kPa). Se aumenta, anche il punto di ebollizione cambierà verso l'alto. Nelle comuni pentole a pressione, ad esempio, la pressione è di circa 200 kPa. Pertanto, il punto di ebollizione aumenta di 20 punti (fino a 20 gradi).
Un esempio di bassa pressione atmosferica sono le aree montuose. Quindi, dato che lì è piuttosto piccolo, l'acqua inizia a bollire ad una temperatura di circa 90 gradi. I residenti di tali aree devono dedicare molto più tempo alla preparazione del cibo. Quindi, ad esempio, per far bollire un uovo, dovrai scaldare l'acqua ad almeno 100 gradi, altrimenti l'albume non si coagulerà.
Il punto di ebollizione di una sostanza dipende dalla pressione del vapore saturo. Il suo effetto sulla temperatura è inversamente proporzionale. Ad esempio, il mercurio bolle quando riscaldato a 357 gradi Celsius. Ciò può essere spiegato dal fatto che la pressione del vapore saturo è di soli 114 Pa (per l'acqua questa cifra è 101.325 Pa).

Ebollizione in condizioni diverse
A seconda delle condizioni e dello stato del liquido, il punto di ebollizione può variare in modo significativo. Ad esempio, vale la pena aggiungere sale al liquido. Gli ioni cloro e sodio sono posti tra le molecole d'acqua. Pertanto, l'ebollizione richiede un ordine di grandezza in più di energia e, di conseguenza, più tempo. Inoltre, tale acqua produce molto meno vapore.
Il bollitore viene utilizzato per far bollire l'acqua condizioni di vita. Se viene utilizzato liquido puro, la temperatura di questo processo è quella standard di 100 gradi. In condizioni simili, l'acqua distillata bolle. Ci vorrà però un po’ meno tempo, vista l’assenza di impurità estranee.
Qual è la differenza tra ebollizione ed evaporazione?
Ogni volta che l'acqua bolle, il vapore viene rilasciato nell'atmosfera. Ma questi due processi non possono essere identificati. Sono solo metodi di vaporizzazione, che avviene in determinate condizioni. Quindi l'ebollizione è del primo tipo. Questo processo è più intenso di quello causato dalla formazione di sacche di vapore. Vale anche la pena notare che il processo di evaporazione avviene esclusivamente sulla superficie dell'acqua. L'ebollizione riguarda l'intero volume del liquido.

Da cosa dipende l'evaporazione?
L'evaporazione è il processo di conversione di un liquido o di un solido in uno stato gassoso. C'è un "volo" di atomi e molecole, la cui connessione con altre particelle è indebolita sotto l'influenza di determinate condizioni. La velocità di evaporazione può variare a causa dei seguenti fattori:
- area superficiale del liquido;
- temperatura della sostanza stessa e dell'ambiente;
- velocità di movimento delle molecole;
- tipo di sostanza.
L'energia dell'acqua bollente è ampiamente utilizzata dalle persone nella vita di tutti i giorni. Questo processo è diventato così banale e familiare che nessuno pensa alla sua natura e alle sue caratteristiche. Tuttavia, una serie di fatti interessanti sono associati all'ebollizione:
- Probabilmente tutti hanno notato che c'è un buco nel coperchio del bollitore, ma poche persone pensano al suo scopo. Viene fatto allo scopo di rilasciare parzialmente il vapore. Altrimenti l'acqua potrebbe schizzare attraverso il beccuccio.
- La durata della cottura di patate, uova e altri prodotti alimentari non dipende dalla potenza del riscaldatore. Tutto ciò che conta è per quanto tempo sono stati esposti all'acqua bollente.
- Un indicatore come il punto di ebollizione non è influenzato dalla potenza. dispositivo di riscaldamento. Può influenzare solo la velocità di evaporazione del liquido.
- Bollire non significa solo scaldare l’acqua. Questo processo può anche causare il congelamento del liquido. Pertanto, durante il processo di ebollizione, è necessario pompare continuamente aria dalla nave.
- Uno dei più problemi attuali per le casalinghe è che il latte può “scappare”. Pertanto, il rischio di questo fenomeno aumenta notevolmente durante il peggioramento del tempo, accompagnato da un calo della pressione atmosferica.
- Maggior parte acqua calda bollente ottenuto in miniere sotterranee profonde.
- Attraverso studi sperimentali, gli scienziati sono riusciti a stabilire che su Marte l'acqua bolle ad una temperatura di 45 gradi Celsius.

L'acqua può bollire a temperatura ambiente?
Attraverso semplici calcoli, gli scienziati sono stati in grado di stabilire che l'acqua può bollire a livello della stratosfera. Condizioni simili possono essere ricreate utilizzando una pompa a vuoto. Tuttavia, un esperimento simile può essere condotto in condizioni più semplici e banali.
In un pallone da un litro è necessario far bollire 200 ml di acqua e, quando il contenitore è pieno di vapore, deve essere chiuso ermeticamente e tolto dal fuoco. Dopo averlo posizionato sopra il cristallizzatore, è necessario attendere la fine del processo di ebollizione. Successivamente, il pallone viene versato acqua fredda. Successivamente, nel contenitore ricomincerà un'intensa ebollizione. Ciò è dovuto al fatto che, sotto l'influenza della bassa temperatura, il vapore situato nella parte superiore del pallone scende.

 Entrata
Entrata