Deformità congenite nei bambini. Malformazioni congenite nei bambini piccoli
Secondo le statistiche, circa il 2% dei bambini nasce con difetti dello sviluppo o altre patologie congenite. Tenendo conto del fatto che alcuni difetti (cuore, reni, polmoni, tratto gastrointestinale) vengono rilevati in età avanzata, a volte negli adulti, questa cifra raggiunge il 5%. Disturbi dello sviluppo particolarmente gravi che si verificano durante fasi iniziali la formazione di organi e tessuti spesso porta all'aborto spontaneo.
Grazie a numerosi studi è stato dimostrato che il 15% dei casi di morte fetale intrauterina sono associati ad anomalie e malformazioni del suo sviluppo.
Esiste una divisione condizionale dei difetti dello sviluppo in maggiori e minori. I difetti maggiori richiedono un trattamento farmacologico serio, a lungo termine, talvolta per tutta la vita. La correzione chirurgica è spesso necessaria per difetti del cuore, del sistema muscolo-scheletrico, del tratto gastrointestinale e altri. I difetti maggiori portano alla disabilità del paziente e alla mortalità precoce. Difetti minori dello sviluppo (anomalie) non sono accompagnati da conseguenze gravi per bambino sano, ma servono come indicatori unici della possibilità della formazione di patologie più gravi nelle generazioni successive. Le cause di un particolare difetto e i meccanismi del suo sviluppo sono spesso impossibili da determinare in modo definitivo. Tuttavia si possono distinguere tre gruppi di malformazioni congenite (CDM) in base alla loro origine: ereditarie, esogene, multifattoriali.
Si ritiene che oltre l'80% di tutte le forme di malformazioni congenite siano associate a disturbi nella struttura del genotipo. Questi difetti si basano su una rottura dell'apparato genetico delle cellule a livello dei singoli geni (malattie genetiche) o dei cromosomi (malattie cromosomiche). Inoltre, i genitori, essendo portatori di informazioni genetiche alterate, si considerano assolutamente sani. Tuttavia, dopo una visita medica approfondita, vengono rilevate piccole anomalie dello sviluppo. A seconda del tipo di eredità, una particolare malattia viene trasmessa con una certa frequenza di generazione in generazione, obbedendo alle leggi della genetica. Le malattie ereditarie e geneticamente determinate includono l'emofilia, un disturbo della coagulazione del sangue; alcuni tipi di anemia associati a ridotta formazione di emoglobina o globuli rossi; difetti renali individuali e altre malattie accompagnate dalla formazione di malformazioni multiple. Tutti loro sono rappresentanti di malattie genetiche. Le malattie cromosomiche sono causate da una violazione del numero o della struttura dei cromosomi. Normalmente, il cariotipo di una persona è rappresentato da 46 cromosomi, uniti in 23 coppie: questi sono cromosomi autosomici. Esistono anche i cromosomi sessuali, il cui insieme nelle donne è rappresentato da due cromosomi X e negli uomini dai cromosomi X e Y. È stato dimostrato che circa il 90% dei feti con anomalie del cariotipo non vengono portati a termine. Nei bambini nati vivi, la metà dei casi di anomalie cromosomiche si verificano sui cromosomi sessuali. La patologia cromosomica è spesso causa di infertilità maschile e femminile e di ritardo mentale. La sindrome di Down è la più comune e la più facilmente riconoscibile. È causato dalla presenza di un 21° cromosoma aggiuntivo. Pertanto, il cariotipo dei pazienti con sindrome di Down contiene 47 autosomi. La frequenza di questa patologia è di 1 su 600-800 bambini nati vivi. Più della metà dei feti affetti da trisomia 21 non vengono portati a termine. Caratteristica aspetto i pazienti possono essere diagnosticati immediatamente dopo la nascita. I bambini hanno una forma degli occhi obliqui (mongoloidi), una piega cutanea negli angoli interni (epicanto), un ponte del naso ampio e appiattito, una lingua sporgente e orecchie basse e dalla forma alterata. La parte posteriore della testa è appiattita, il collo è corto. Nella maggior parte dei casi, la sindrome di Down rivela anche un difetto cardiaco congenito, principalmente un difetto nei setti tra le sue camere. Anomalie nello sviluppo del tratto gastrointestinale si riscontrano un po' meno frequentemente. Caratterizzato da un pronunciato ritardo nello sviluppo psicofisico, evidente già nel primo anno di vita. Questi bambini in seguito iniziano a sedersi e camminare. Il loro tono muscolare è ridotto e le articolazioni sono sciolte. L'intelletto è particolarmente colpito. È possibile solo la formazione sulle competenze self-service. Il trattamento è mirato a correggere le malformazioni degli organi interni.
Per migliorare la funzione del sistema nervoso centrale, viene utilizzata la terapia stimolante: nootropi, vitamine, in particolare il gruppo B. Meno conosciute sono le sindromi di Edwards e Patau. L'incidenza della sindrome di Edwards (cromosoma 18 in più) è di 1 su 8000 nati. Il rapporto tra maschi e femmine è 1: 4. La gravidanza di solito procede normalmente, caratterizzata solo da un basso peso fetale. Con questa sindrome, i difetti dello sviluppo sono generalmente multipli: pseudoartrosi labbro superiore e palato, rene a ferro di cavallo, deformazione delle dita delle mani e dei piedi. A quasi tutti i pazienti viene diagnosticato un difetto cardiaco, che è la causa della loro morte prematura (di solito nei primi 3 mesi di vita). L'aspettativa di vita massima per la sindrome di Edwards è di 15 anni.
La sindrome di Patau (triplicazione del cromosoma 13) è ancora meno comune; la sua incidenza è di circa 1 su 20.000 nati vivi. La maggior parte dei pazienti muore nel primo anno di vita; molto raramente vive oltre i 10 anni; Difetti caratteristici sono il cranio facciale, la riduzione delle dimensioni della testa (microcefalia), le deformità delle dita delle mani e dei piedi e le malformazioni del cuore e dei reni. Il ritardo nello sviluppo psicofisico nei pazienti con sindromi di Edwards e Patau è molto pronunciato.
I disturbi nel sistema dei cromosomi sessuali sono spesso associati ad un aumento o una diminuzione del loro numero. Le più famose sono la sindrome di Shereshevsky-Turner (assenza di un cromosoma X nel cariotipo nelle donne) e la sindrome di Klinefelter (aumento del numero di cromosomi X nel cariotipo maschile). L'incidenza della sindrome di Shereshevsky-Turner è di 1 su 100.000 ragazze nate vive. Fino al 95% dei feti affetti da questa patologia vengono abortiti spontaneamente. Segni clinici La sindrome è bassa statura, pieghe cutanee ai lati del collo, bassa crescita dei capelli sulla fronte e sulla parte posteriore della testa. A volte ci sono deformità dello sterno e altre anomalie ossee, difetti cardiaci congeniti. Le gonadi sono praticamente sottosviluppate e i pazienti sono sterili. Nel 18% dei casi c'è un ritardo sviluppo mentale. Il trattamento consiste nella sostituzione con ormoni sessuali femminili.
L'incidenza della sindrome di Klinefelter è di 1 su 1000 nati vivi di sesso maschile. La morte fetale nel periodo prenatale è insolita per questo. La malattia viene rilevata più spesso durante la pubertà. Esistono due tipi di sviluppo della malattia. Il primo è caratterizzato da arresto della crescita, aumentato ghiandole mammarie nei ragazzi con sviluppo normale dei caratteri sessuali secondari secondo il tipo maschile. Nel secondo caso si notano un fisico eunucoide, un sottosviluppo del pene e una leggera crescita di peli. In entrambi i casi le gonadi sono ridotte di dimensioni e atrofiche. La sindrome di Klinefelter non è un problema pediatrico serio, poiché viene diagnosticata più spesso negli adulti durante l'esame per l'infertilità. Non sono presenti difetti di sviluppo di altri organi. In alcuni casi, i pazienti sono alquanto ritardati nello sviluppo mentale. Il trattamento è ormonale, effettuato da un endocrinologo.
Per aiutare a risolvere i problemi legati al rischio di malattie genetiche in famiglia, è disponibile la consulenza genetica. Per le coppie sposate il cui primo figlio è nato con un difetto congenito o uno dei loro parenti stretti è affetto dalla malattia, è necessario determinare il grado di rischio di avere un figlio malato. Per i genitori anziani aumenta anche il rischio di anomalie nell'apparato genetico della prole. Un genetista, parlando con le coppie sposate, dovrebbe scoprirlo nel modo più completo possibile storia genetica famiglie nel numero massimo di generazioni. I futuri genitori vengono sottoposti a una visita medica completa. Se si sospetta un portatore di informazioni genetiche anomale, è possibile effettuare una serie di studi specifici sul DNA. Pertanto, la consulenza genetica mira a prevenire la nascita di un bambino con una patologia ereditaria prevedendo il rischio del suo sviluppo in famiglia.
Difetti esogeni e malattie congenite sono causati da danni all'embrione (embrione) e al feto sotto l'influenza di fattori ambiente esterno. I fattori dannosi (teratogeni) includono il fumo da parte di una donna incinta, il consumo di alcol e altri medicinali, infezioni intrauterine e alcune malattie non infettive della futura mamma (diabete mellito, tumori pelvici), rischi professionali (contatto con sostanze chimiche aggressive e veleni, radiazioni ionizzanti, ecc.), condizioni ambientali sfavorevoli. L'esposizione più pericolosa ad un agente dannoso avviene nelle prime fasi della gravidanza, al momento della formazione di organi e sistemi. È in questo periodo che si formano i principali difetti dello sviluppo, spesso combinati.
Ce ne sono due periodo critico, quando il pericolo di danni è particolarmente grande: dal momento del concepimento al 6-7° giorno e dalla 3a all'8a settimana di gravidanza. Lo sviluppo di un difetto congenito del cervello e del midollo spinale è molto probabile in caso di esposizione a un agente dannoso durante la 2-11a settimana di gravidanza. I difetti cardiaci e oculari si verificano più spesso nella 3-7a settimana, i difetti dell'orecchio e dei denti - nella 6-11a settimana di sviluppo intrauterino. La formazione degli arti viene solitamente interrotta a 2-8 settimane di gravidanza e lo sviluppo degli organi digestivi a 11-12 settimane.
L'esposizione a fattori teratogeni nei periodi successivi non porta sempre alla formazione di patologie congenite, ma influisce necessariamente negativamente sullo sviluppo del feto e sul suo adattamento alle condizioni di esistenza extrauterine.
Difetti di questo tipo non vengono ereditati, poiché insorgono accidentalmente (spontaneamente). Il più studiato è l'effetto dell'alcol, della nicotina e di alcuni virus sull'embrione in via di sviluppo. Pertanto, l'embriopatia alcolica è caratterizzata da una combinazione di difetti del sistema nervoso centrale e del cranio facciale, difetti cardiaci, danni al sistema urinario e alle articolazioni. Il tasso di mortalità raggiunge il 17% e i bambini sopravvissuti spesso presentano un grave ritardo mentale. Tra i neonati con sindrome alcolica prevalgono le femmine; i ragazzi muoiono in utero o immediatamente dopo la nascita. La dose critica per il consumo quotidiano di alcol da parte di una donna incinta è considerata pari a 60 g. La nicotina ha un effetto particolarmente forte sul sistema nervoso centrale del feto, rallentando lo sviluppo motorio e neuropsichico del neonato. Inoltre, aumenta la permeabilità dei vasi placentari, facilitando la penetrazione di altri agenti dannosi (tossine, virus) nel feto. Quando il feto viene infettato dal virus della rosolia nell'utero, è caratteristica una triade di sintomi: difetti cardiaci, difetti oculari e sordità congenita. L'infezione da virus dell'herpes porta alla formazione di difetti nel cervello, negli occhi e nelle lesioni cutanee. I citomegalovirus causano lesioni della parte centrale sistema nervoso con lo sviluppo della microcefalia, occhi con alterazioni della retina e successiva cecità. Ci sono anche difetti cardiaci e renali. Anche i difetti congeniti del cervello (idro o microcefalia) e degli occhi (coloboma, microftalmia) si formano sotto l'influenza del toxoplasma. Molto spesso, nei neonati di madri con diabete mellito non trattato o insufficientemente compensato vengono rilevati difetti dello sviluppo, a volte multipli. Questo è caratterizzato dalla sconfitta sistema cardiovascolare, sistema muscolo-scheletrico, occhi. Durante la gravidanza non esistono farmaci innocui per il feto. Un effetto teratogeno può verificarsi anche con l’uso di dosi terapeutiche, a seconda della sensibilità individuale del corpo della donna incinta. Sedativi e i farmaci che abbassano la pressione sanguigna possono causare deformità degli arti, anomalie oculari e difetti di alcuni organi interni. Sotto l'influenza degli anticonvulsivanti, si sviluppa una carenza nel corpo acido folico, che porta a danni al cranio e al cuore del viso. I farmaci che riducono la coagulazione del sangue influenzano la formazione del tessuto cartilagineo e del nervo ottico. L'uso di antibiotici all'inizio della gravidanza può causare labioschisi e palatoschisi nel feto, sottosviluppo della mascella inferiore e accorciamento degli arti. I farmaci usati per trattare le allergie spesso causano difetti del sistema digestivo, fusione delle dita delle mani o dei piedi. Una cattiva alimentazione di una donna incinta con una carenza di microelementi (in particolare zinco e magnesio) può causare danni intrauterini al sistema nervoso centrale del feto. L'impatto di altri fattori ambientali è meno comune e non ha manifestazioni specifiche. I difetti multifattoriali sono difetti dello sviluppo e malattie congenite causati dall'azione combinata di fattori genetici e agenti esogeni. In questo caso, un fattore esterno contribuisce alla manifestazione di una predisposizione genetica alla patologia congenita, vale a dire uno o entrambi i genitori hanno alcuni difetti nell'apparato genetico, ma possono manifestarsi solo sotto l'influenza di un fattore esogeno sufficientemente forte. La maggior parte dei difetti di questo gruppo possono essere ereditati, ma non strettamente secondo la legge. La consulenza genetica in questo caso è difficile, ma se ci sono indicazioni di un difetto ricorrente in diverse generazioni della stessa famiglia, è possibile prevedere il rischio che si manifesti nella prole. Questo gruppo è rappresentato da numerosi difetti cardiaci (difetti del setto e della valvola, sottosviluppo delle camere, anomalie dei grandi vasi); sistema muscolo-scheletrico (fessure del labbro superiore e del palato, completa assenza di arti o parti di essi, aumento del numero delle dita - polidattilia, loro fusione tra loro - sindattilia, lussazione congenita dell'anca, piede torto congenito); apparato genito-urinario (assenza o riduzione delle dimensioni dei reni, accessori, doppi reni e ureteri, danno renale cistico, dilatazione del sistema collettore renale, neoputcenia dei testicoli - criptorchidismo); apparato digerente (rotazione intestinale incompleta; atresia - sottosviluppo dell'esofago, duodeno, ano; stenosi pilorica - restringimento della sezione escretoria dello stomaco a causa dell'eccessivo sviluppo dello strato muscolare). La diagnosi di malformazioni congenite degli organi interni richiede l'uso di metodi aggiuntivi ricerca, poiché l'esame del bambino consente solo di sospettare la presenza di patologia. I difetti cardiaci si manifestano più chiaramente dal punto di vista clinico; pallore o cianosi della pelle, respiro accelerato (mancanza di respiro), che aumenta con l'alimentazione o l'attività fisica del bambino, battito cardiaco accelerato, presenza di un soffio sistolico durante l'auscultazione (ascolto), aumento delle dimensioni del fegato. Anomalie minori del cuore non sono accompagnate da cambiamenti nella circolazione sanguigna, nelle dimensioni del cuore o nella sua contrattilità. Di norma, si tratta di piccoli fori nel setto, restringimento lievemente espresso di grandi vasi, strutture aggiuntive nelle cavità del cuore. L'unica manifestazione clinica è un lieve rumore aggiuntivo durante l'auscultazione. Si possono sospettare anomalie nello sviluppo del tratto gastrointestinale se il bambino presenta rigurgito o vomito frequenti e abbondanti (a volte mescolati con bile o sangue) fin dalla nascita; mancanza di feci, scarso aumento di peso (aumento della malnutrizione). La diagnosi dei difetti del sistema urinario è solitamente difficile. Sono più spesso rilevati negli anziani infanzia con lo sviluppo di malattie infiammatorie nel sistema urinario e durante un esame strumentale del paziente. Pertanto, se ci sono piccole anomalie dello sviluppo nei neonati, segni di malattia renale nei genitori o cambiamenti nei test delle urine, è necessario condurre un esame ecografico dei reni, seguito da una consultazione con un nefrologo.
Nella medicina moderna, un ruolo importante è dato alla diagnostica prenatale (prenatale) con l'obiettivo di individuare tempestivamente la patologia fetale. L'esame ecografico (US) occupa un posto speciale in esso. Questo metodo è sicuro per la donna incinta e per il feto ed è molto istruttivo. Con il suo aiuto, già fasi iniziali gravidanza, puoi rilevare il suo decorso sfavorevole. Grazie al miglioramento caratteristiche tecniche Gli scanner a ultrasuoni hanno permesso di ottenere un'immagine quasi fotografica del feto, il che significa che è aumentata la capacità di rilevare malformazioni congenite. Attualmente, ogni donna incinta visitata da un medico di una clinica prenatale deve sottoporsi a un'ecografia del feto in ogni trimestre di gravidanza. Se viene rilevata un'anomalia nello sviluppo fetale, viene sollevata la questione del mantenimento o dell'interruzione della gravidanza. Se è necessario chiarire la diagnosi, nonché identificare patologie genetiche e cromosomiche del feto, viene determinato ed esaminato il livello di ormoni specifici nel sangue e nelle urine della donna incinta. liquido amniotico, che contengono uno speciale enzima: l'a-fetoproteina. È prodotto dal fegato e dall'intestino del feto e da alcune altre strutture. Il suo livello di solito aumenta con malformazioni del cervello e del midollo spinale e la sua diminuzione può indicare la presenza della sindrome di Down nel feto. Pertanto, lo sviluppo della consulenza genetica e dei metodi di diagnosi prenatale può ridurre significativamente il rischio di avere un bambino con una patologia congenita.
Malformazioni congenite si osservano nell'1,5-3,5% delle nascite. L’importanza del problema è sottolineata dal fatto che la mortalità per malformazioni congenite è al terzo posto struttura generale mortalità dei bambini nel primo anno di vita.
Sintomi generali le malformazioni congenite degli organi interni non sempre destano preoccupazione personale di servizio. Nella maggior parte dei difetti dello sviluppo, il comportamento del bambino cambia indistintamente e in alcuni casi è necessaria l’osservazione a lungo termine.
La questione della scelta dei tempi dell'intervento chirurgico è molto importante. Nei neonati e nei bambini ciò è dettato da indicazioni assolute per un intervento chirurgico urgente. Tuttavia, nei bambini indeboliti e prematuri, in alcuni casi è necessario posticipare i tempi dell'intervento chirurgico.
Di seguito vengono descritte le malformazioni più comuni che richiedono un intervento chirurgico.
Labbro leporino e palatoschisi. Questi difetti dello sviluppo sono accompagnati da disturbi della suzione, difficoltà nel parlare, i bambini sono soggetti a otite media, catarro, ecc. L'ignoranza dei tempi del trattamento chirurgico porta al fatto che i bambini vengono inviati ai reparti chirurgici troppo presto o irragionevolmente tardi, per cui l'operazione non dà buoni risultati estetici e funzionali. In questi casi è indicato il trattamento ortodontico e fonetico a lungo termine.
Il labbro leporino (labbro leporino) in combinazione con un difetto del processo alveolare della mascella superiore è soggetto a trattamento chirurgico dai 4-5 mesi di vita. Si consiglia di intervenire su un difetto incompleto del solo labbro superiore più tardi: a 10-12 mesi. I bambini con un difetto incompleto possono allattare al seno della madre, ma con un difetto completo necessitano di essere nutriti con un cucchiaio o attraverso uno speciale capezzolo lungo con una posizione elevata della testa. Varie forme la palatoschisi è soggetta ad intervento chirurgico al 6-7o anno di vita. L'alimentazione di tali pazienti viene effettuata allo stesso modo del labbro leporino completo.
Nel periodo postoperatorio, le mani dei bambini devono essere fissate per evitare la rottura delle suture. La rottura parziale delle suture viene eliminata unendo i bordi della ferita con un cerotto adesivo. A casa, i bambini vengono nutriti con cibo liquido da un cucchiaio.
Ernie congenite. Spesso si verificano ernie strozzate, soprattutto nell'infanzia nel primo anno di vita. Le ernie incarcerate si manifestano con ansia, urla, talvolta pallore e sudorazione della pelle, e sono accompagnate da gravi sintomi di ostruzione intestinale (gonfiore, vomito). Il tumore erniario diventa elastico e sensibile alla pressione e solitamente non può essere ridotto.
I bambini con ernia inguinale senza strangolamento vengono mandati in ospedale all'età di più di 6 mesi. Un'ernia inguinale strozzata viene operata entro le prime ore.
Ernie ombelicali abbastanza comune, poiché dopo la caduta del cordone ombelicale, il foro nella parete addominale non si chiude completamente. Ci sono piccole aperture erniarie, delle dimensioni di una ciliegia, e meno spesso – grandi aperture erniarie che consentono il passaggio di 1-2 dita. A differenza delle ernie inguinali, qui non si osserva quasi alcuno strangolamento. Tuttavia, una grave protrusione del sacco erniario con tensione addominale è accompagnata da ansia, vomito frequente e scarso aumento di peso.
Il trattamento conservativo delle piccole ernie ombelicali ha successo nella stragrande maggioranza dei casi. In questo caso, dopo la riduzione, le pieghe della pelle su entrambi i lati dell'ombelico vengono raccolte con un'ampia benda adesiva fissante. Le grandi ernie ombelicali sono soggette a trattamento chirurgico dopo i 2 mesi di vita. Il trattamento conservativo con cerotto adesivo non ha successo nei bambini di età superiore a 6 mesi e pertanto per loro è indicato l'intervento chirurgico.
Ernie fetali cordone ombelicale con organi ectopici cavità addominale sono soggetti a trattamento chirurgico nelle prime ore di vita del bambino.
Le ernie diaframmatiche congenite sono molto difficili da diagnosticare. In questo caso gli organi addominali penetrano nel torace nei punti in cui l'aorta, la vena cava, l'esofago e il nervo splancnico passano attraverso il diaframma o un'apertura patologica del diaframma. Un'ernia iatale da scorrimento può manifestarsi nascosta, ma può essere accompagnata da vomito dopo ogni pasto, che porta a grave distrofia.
Con l'ernia diaframmatica, si nota un suono di percussione squadrato e una respirazione indebolita sulla parte corrispondente del torace, che ricorda l'immagine del pneumotorace. Si sentono forti rumori intestinali, così forti che i genitori del bambino li notano. Il trattamento dell'ernia diaframmatica è chirurgico.
Una patologia grave è il movimento di ampie aree del tratto gastrointestinale (stomaco, intestino tenue e crasso, milza e persino fegato) nella cavità toracica. Si tratta di ernie diaframmatiche pleuroperitoneali. In questa rara condizione, il bambino subito dopo la nascita presenta grave difficoltà respiratoria e cianosi. L'operazione viene eseguita immediatamente.
Chiusura dell'ano e del retto. La forma più comune di questa anomalia è l'atresia semplice. ano quando il foro è chiuso con una membrana sottile o una pelle sottile. Nella zona anale sono visibili creste cutanee gonfie. L'ampolla del retto, piena di meconio, sporge in avanti a forma di volta. Subito dopo la nascita, il bambino mostra segni di ostruzione intestinale. I bambini diventano irrequieti, rifiutano di allattare e presto compaiono vomito e flatulenza. Se il bambino non viene inviato tempestivamente al reparto chirurgico, tali bambini muoiono entro pochi giorni per intossicazione e peritonite.
Se c'è una crescita eccessiva del retto con la presenza delle sue fistole - fori che possono aprirsi nella vescica, nell'uretra, nella vagina o direttamente all'esterno, nella maggior parte dei casi non si verificano condizioni acute di pericolo. Tuttavia, le fistole non possono garantire il completo rilascio dell’intestino dalla materia fecale, il che spesso porta a un’infezione del tratto urinario. Si verificano costipazione e flatulenza e nei ragazzi appare il rossore dell'apertura uretrale. Per questa patologia è indicato un intervento chirurgico precoce.
Non fusione degli archi di una o più vertebre accompagnato da una protrusione simil-tumorale delle meningi e prende il nome di “spina bifida”. Più spesso la placca cerebrale è ricoperta da un sottile strato di tessuto connettivo o pelle. Il sacco erniario è pieno di liquido e formato dalla pia madre. La dura madre non partecipa alla formazione del tumore. Spesso nel processo è coinvolto il midollo spinale. In questo caso si osservano sintomi neurologici.
Le ernie spinali e craniche sono soggette a trattamento chirurgico urgente in caso di sfondamento o minaccia di sfondamento del sacco erniario con fuoriuscita di liquido cerebrospinale.
Malattia di Hirschsprung o megacolon– ingrossamento congenito dell’intestino crasso – si accompagna in forma acuta a stitichezza fin dai primi giorni di vita del bambino. In questo caso, si verifica un'ostruzione intestinale, i clisteri non aiutano e le condizioni del bambino peggiorano. Nella forma subacuta, un sintomo caratteristico è la flatulenza. Le feci, che raramente stanno in piedi da sole, sono simili alle feci delle pecore. Il trattamento è solitamente chirurgico.
Tumori vascolari congeniti – angiomi– più spesso localizzato sul viso. Sono soggetti a trattamento fin dal primo mese di vita, poiché tendono ad aumentare e degenerare rapidamente. Vengono utilizzate l'escissione, l'elettrocoagulazione, la cauterizzazione con neve di acido carbonico e la radioterapia a fuoco ravvicinato.
Le statistiche sono inesorabili: ogni anno nascono più di 50mila bambini difetti di sviluppo. Questa è la cosa peggiore che possa accadere in una famiglia, perché ogni genitore, dal momento del concepimento, sogna un bambino sano e a tutti gli effetti. E la notizia che il loro bambino tanto atteso ha qualche difetto inorridisce i genitori.
Spesso la vita di un bambino con una patologia congenita si deteriora molto rapidamente. Non tutti i bambini sono in grado di sopportare il carico portato da questo o quel difetto. Tuttavia, quando il corretto atteggiamento dei genitori nei confronti della malattia il bambino può essere messo in piedi e diventare un membro a pieno titolo della società.
La cosa peggiore è che non tutti i genitori sono pronti per la nascita di un bambino del genere, poiché gli ultrasuoni e altri test non hanno diagnosticato la patologia durante la gravidanza. Le ragioni delle anomalie dello sviluppo possono essere molte. Il fattore più comune è l'ereditarietà. Se in una famiglia è già nato un bambino con un difetto congenito, esiste la possibilità che esca un erede con la stessa diagnosi.
Di norma, provocano lo sviluppo del difetto cattive abitudini futuri genitori. Alcol, tabacco, droghe, promiscuità: tutto ciò può diventare un fattore scatenante. Se il corredo cromosomico dei futuri genitori è disturbato, anche il bambino avrà una grave patologia cromosomica.
Sono le violazioni del set cromosomico che possono influenzare lo sviluppo negativo della gravidanza o la morte del feto. Coloro che riescono a dare alla luce un bambino del genere danno alla luce un bambino con un difetto congenito.
Tuttavia, accade che un bambino con un set cromosomico del tutto normale nasca con un difetto. La ragione del suo aspetto è uno dei fattori pericolosi:
- La futura mamma, mentre trasportava il bambino, ha sofferto di una grave infezione (rosolia, herpes, toxoplasmosi).
- La donna assumeva farmaci controindicati durante la gravidanza (antibiotici, aspirina in grandi quantità, ecc.).
- Durante la gravidanza, la donna si “attaccava” al biberon.
- La futura mamma si trovava in una zona di eccessiva attività solare.
Questi fattori possono influenzare la futura mamma in qualsiasi momento, ma dipende dalla settimana cosa accadrà al bambino. Nelle prime settimane, l'influenza di un fattore pericoloso porta quasi certamente alla morte del feto. Se è sorto durante il periodo 4-12 settimane, allora sono sotto attacco organi interni Bambino. Di conseguenza, il bambino sviluppa uno o più organi in modo errato.
Esistono due modi per prevenire la nascita di un bambino affetto da patologia. Per prima cosa, attenersi a immagine sana vita prima del concepimento e durante la gravidanza. E in secondo luogo, monitorare attivamente lo sviluppo del bambino durante la gravidanza. È molto importante sottoporsi a tutti gli esami consigliati dal medico e sottoporsi a un'ecografia, perché rivelano la possibilità di dare alla luce un bambino con un difetto congenito.
I difetti dello sviluppo infantile sono suddivisi nei seguenti tipi:
- Anomalie dello sviluppo fisico;
- Difetti metabolici;
- Malattie genetiche (ad esempio emofilia, sindrome di Down, sindrome di Klinefelter, daltonismo, ecc.).
Quando viene rilevata una malattia, è molto importante decidere da soli se sei pronto a continuare a portare il bambino o se vuoi rifiutarti di dare alla luce un bambino malato. Se la scelta è a favore del parto, allora abbi pazienza e forza, perché la cosa principale è che la maggior parte dei difetti può essere compensata con l'aiuto di un trattamento costante. La maggior parte delle cliniche moderne trattano con successo malattie genetiche e, se il trattamento non è efficace, aiutano il bambino ad adattarsi socialmente nella società.
La nota espressione secondo cui "la salute dei bambini non ancora nati è nelle nostre mani" cessa di essere banale quando in famiglia nasce un bambino con difetti congeniti dello sviluppo. Oggi molti giovani bevono molto, fumano e si drogano, senza pensare affatto che spesso i propri figli devono pagare per il loro stile di vita frivolo e selvaggio. Tuttavia, condizioni ambientali sfavorevoli, aumento della radiazione di fondo, età avanzata dei genitori e molti altri fattori spesso portano al fatto che famiglie assolutamente sane a volte incontrano malformazioni congenite nei bambini. In ogni caso, la struttura o il funzionamento anormale dell'uno o dell'altro organo del bambino provoca quasi sempre uno shock psicologico nei genitori e talvolta porta addirittura alla disgregazione della famiglia.
Ragioni
Le anomalie congenite nello sviluppo di un bambino possono essere ereditarie (causate da mutazioni genetiche e patologie cromosomiche), teratogene (acquisite durante la gravidanza) e multifattoriali (una combinazione dei primi due fattori). Tra i vari difetti ereditari, va evidenziata una malattia cromosomica abbastanza comune: la sindrome di Down, in cui l'aspetto caratteristico del bambino indica il suo ritardo fisico e mentale. Le deviazioni nello sviluppo intrauterino del feto sono causate da patologie endocrine e ormonali di una donna incinta, lesioni durante la gravidanza, oligoidramnios, malattie virali (rosolia, influenza), intossicazione del corpo con sostanze chimiche e la futura mamma assume antidepressivi, antibiotici, e anticonvulsivanti. E a volte embriologi, genetisti e neonatologi non riescono a stabilire le vere cause delle anomalie congenite.
Difetti degli organi interni
Esistono moltissime deviazioni patologiche nello sviluppo dei bambini, poiché anormali struttura anatomica oppure una condizione degenerativa-distrofica può colpire assolutamente qualsiasi organo del bambino. Un'anomalia comune è la cardiopatia congenita, accompagnata da difetti del setto interventricolare e interatriale, stenosi (restringimento) della valvola aortica, che portano a cambiamenti nell'emodinamica intracardiaca. Sono comuni anche patologie renali congenite: fusione, assenza di un rene (agenesia) o comparsa di un terzo. Sono noti casi di allungamento e ispessimento anomalo dell'intestino crasso (malattia di Hirschsprung), comparsa di ernia diaframmatica e assenza di testicoli nello scroto (criptorchidismo).
Difetti esterni
Naturalmente, le manifestazioni esterne dei difetti dello sviluppo infantile sembrano molto sgradevoli. Un bambino può nascere con arti superiori e inferiori deformati o anormalmente corti (piede torto, zoppia), lussazione congenita dell'anca, labbro leporino, palatoschisi, protrusione Petto, curve patologiche della colonna vertebrale. Spesso la pelle è completamente priva del pigmento melanina (albinismo), quindi l'esposizione al sole è controindicata per il bambino. A volte si osserva un aumento del numero (polidattilia) delle dita dei piedi e delle mani o la loro fusione (sindattilia), l'assenza dell'ano (atresia), una diminuzione delle dimensioni del cranio (microcefalia) e l'abbassamento della palpebra superiore (itosi).
Altre anomalie
Va notato che il numeroso elenco di difetti congeniti comprende anche malattie come il disturbo del fattore di coagulazione del sangue (emofilia), daltonismo (daltonismo) e la spina bifida. Molte delle patologie elencate sono curabili, alcune portano a disabilità permanente, ma sfortunatamente ci sono difetti per i quali il bambino non è vitale. Questi includono la completa assenza di polmoni o reni, pelle(acrania) o emisferi cerebrali (anencefalia).
Le informazioni sul nostro sito web sono di natura informativa ed educativa. Tuttavia, queste informazioni non vogliono in alcun modo essere una guida all’automedicazione. Assicurati di consultare il tuo medico.
Le malformazioni anatomiche maggiori vengono solitamente diagnosticate durante i primi giorni di vita. Alcuni, come l'ernia ombelicale, la gastroschisi, l'ernia diaframmatica e l'atresia anale, sono evidenti alla visita medica iniziale. Altri si presentano nei primi giorni di vita con incapacità di nutrirsi per via enterale (atresia intestinale, microcolon, fistola tracheoesofagea e ostruzione meconeale). Altre malformazioni presentano dilemmi diagnostici e terapeutici impegnativi dopo il periodo neonatale. Problemi clinici specifici sono discussi nelle sezioni seguenti.
Malrotazione intestinale e volvolo dell'intestino medio
La malrotazione intestinale si verifica a causa della rotazione incompleta dell'intestino medio del feto mentre l'intestino migra nella cavità addominale. Una rotazione anormale può portare a un'ostruzione duodenale parziale o completa da parte di bande peritoneali embrionali (sindrome di Ledd) o, cosa più importante, al volvolo dell'intestino medio. L'intestino medio (dal duodeno al colon trasverso) e i suoi vasi si trovano su una gamba, se la gamba è ruotata può verificarsi un infarto dell'intero intestino; I bambini affetti da onfalocele presentano quasi sempre una malrotazione intestinale. Clinicamente, neonati e bambini mostrano segni di grave ostruzione intestinale (vomito biliare) o di addome acuto, perforazione intestinale e sepsi. Il trattamento è chirurgico: eliminazione del volvolo e fissazione dell'intestino, resezione dell'intestino non vitale. Nei neonati con condizioni potenzialmente letali prima dell'intervento chirurgico, è necessario il supporto ventilatorio postoperatorio e la nutrizione parenterale.
diverticolo di Meckel
Il diverticolo di Meckel è un dotto ombelicale-mesenterico o vitellino conservato e attira l'attenzione del medico a causa del sanguinamento indolore dal tratto gastrointestinale inferiore. Il sanguinamento è associato ad ulcerazione della mucosa intestinale derivante dalla secrezione di acido cloridrico. Sebbene di solito sia transitorio, sono stati segnalati casi di sanguinamento massiccio e pericoloso per la vita. Può essere difficile da diagnosticare perché spesso è una delle eccezioni. La scansione della mucosa gastrica con l'isotopo del tecnezio pertecnetato rivela un diverticolo. La terapia è di supporto, ma occorre prestare particolare attenzione alle trasfusioni di sangue. La resezione chirurgica del diverticolo è il metodo di trattamento definitivo.

La malattia di Hirschsprung
La malattia di Hirschsprung (aganglionosi congenita del colon) è caratterizzata dall'assenza di cellule gangliari parasimpatiche nel retto e nel colon e talvolta nell'intestino tenue. L'assenza di gangli provoca il restringimento dell'intestino distale e la distensione dell'intestino prossimale normale. Il quadro clinico può essere lieve e manifestarsi con gonfiore e ritenzione di feci, oppure grave, con megacolon tossico, peritonite e perforazione intestinale. Il megacolon tossico di solito si verifica nei bambini età più giovane; i suoi tassi di mortalità segnalati raggiungono il 75%.
La diagnosi della malattia di Hirschsprung viene talvolta effettuata mediante l'anamnesi e l'esame obiettivo. Un clistere baritato rivela un segmento ristretto con una parte prossimale dilatata dell'intestino. La diagnosi finale viene effettuata sulla base dell'assenza di cellule gangliari nel campione bioptico del retto e/o del colon. Il trattamento del megacolon tossico è di supporto (ridilatazione del volume e antibiotici) e cardinale (decompressione chirurgica tramite colostomia).
Altri disturbi intestinali
I disturbi intestinali possono causare sanguinamento, ostruzione o infiammazione, nonché patologie secondarie come malassorbimento e perforazione intestinale. Il sanguinamento gastrointestinale nei bambini si verifica a causa di malattie infiammatorie:
-
vene varicose;
malformazioni vascolari.

Nonostante ciò, la gastrite da stress o le ulcere da stress si verificano nei bambini gravemente malati ulcera pepticaè una patologia primaria rara nei pazienti pediatrici. Si deve considerare la necessità di una somministrazione profilattica di antiacidi o di antagonisti dei recettori H2 dell’istamina. L'intussuscezione, la torsione dell'intestino attorno ad aderenze congenite o post-chirurgiche e la torsione dell'intestino su se stesso (volvolo) possono portare all'ostruzione intestinale. L’intussuscezione è un evento relativamente comune nei bambini fascia di età e di solito si verifica nell'ileo distale. In alcuni casi si possono riscontrare punti principali come un polipo o un gonfiore localizzato (come accade nella porpora di Henoch-Schönlein). Il trattamento dell'invaginazione può essere chirurgico o conservativo (nei pazienti senza segni di necrosi intestinale) con bario, aria o soluzione salina. Le malattie infiammatorie intestinali comprendono il morbo di Crohn e l'enterite regionale. Gli agenti infettivi che causano infiammazione includono Salmonella, Shigella e Yersinia. In questi pazienti sono comuni diarrea, malassorbimento (soprattutto intolleranza al lattosio) e sangue nelle feci. Possono anche avere una pancia acuta tossica.
Enterocolite necrotizzante
L'enterocolite necrotizzante (NEC) è una malattia fulminante comune dei neonati caratterizzata da ulcerazione e necrosi dell'intestino tenue. La sua causa è sconosciuta, ma la malattia è probabilmente multifattoriale. Il fattore di rischio più significativo è la prematurità. Ciò è probabilmente dovuto a una combinazione di ischemia intestinale, alimentazione orale e microrganismi patogeni. Anche i seguenti fattori svolgono un ruolo nel verificarsi della NEC:
cateterizzazione dell'arteria ombelicale;
asfissia perinatale;
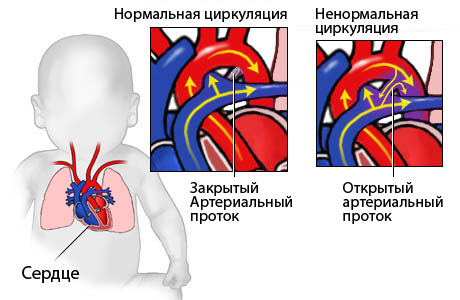
sindrome da distress respiratorio;
dotto arterioso aperto.
L'incidenza della NEC è in aumento; dall'1% al 5% dei neonati ricoverati in terapia intensiva neonatale presenta questa patologia. I segni iniziali più comuni sono: intolleranza alimentare, gonfiore e sangue nelle feci. Dopo di che possono verificarsi ostruzione intestinale, perforazione intestinale e sepsi. Il trattamento comprende la sospensione della nutrizione enterale, la decompressione nasogastrica, i liquidi per via endovenosa, il supporto emodinamico, gli antibiotici appropriati e l'intervento chirurgico se vi è evidenza di un addome acuto con aria libera nella cavità peritoneale. I neonati con peso alla nascita molto basso ed estremamente basso possono trarre beneficio dal drenaggio peritoneale. La nutrizione parenterale è spesso necessaria solo per poche settimane e l'ostruzione intestinale può verificarsi settimane o mesi dopo con un decorso relativamente benigno.

Insufficienza epatica
L'insufficienza epatica si verifica con malattie epatiche croniche o acute. L'insufficienza epatica cronica può essere causata da atresia biliare, errori congeniti del metabolismo (tirosinosi, morbo di Wilson, galattosemia, fibrosi cistica); o epatite cronica. Spesso i bambini affetti da patologie croniche presentano segni di disfunzione sintetica (malnutrizione, ipoalbuminemia, disturbi della coagulazione), disfunzione degradativa (ittero e iperammoniemia) e di ipertensione portale (vene varicose e ipersplenismo). L'insufficienza epatica acuta si verifica più spesso con l'epatite infettiva A e B.
Una visita medica rivela segni di sanguinamento, gonfiore e altri danni agli organi, compreso un aumento delle dimensioni del fegato e della milza. Gli studi di laboratorio dovrebbero includere test della funzione sintetica (albumina, tempo di protrombina, tempo parziale di tromboplastina), prodotti metabolici (bilirubina, ammoniaca) e la determinazione delle concentrazioni degli enzimi epatici. L'ecografia, gli esami radiografici con contrasto e la biopsia epatica sono prescritti individualmente.
Le complicanze potenzialmente letali dell'insufficienza epatica comprendono sanguinamento acuto e disturbi cardiovascolari (dovuti alla massiccia ipovolemia intravascolare dovuta al movimento dei fluidi), ipertensione intracranica dovuta a encefalopatia tossica. La strategia di trattamento è di attesa e di supporto. Le infusioni di soluzione di destrosio al 10% garantiscono un adeguato apporto di carboidrati. Una dieta a basso contenuto proteico riduce al minimo la sintesi di ammoniaca. La coagulazione viene mantenuta con vitamina K, plasma fresco congelato e piastrine secondo necessità. La plasmaferesi con plasma fresco congelato e piastrine migliora la coagulazione e mantiene la normovolemia. I clisteri orali di lattulosio e neomicina riducono il ciclo enteroepatico di sintesi e assorbimento dell'ammoniaca. Inoltre, la funzione cardiovascolare e respiratoria deve essere attentamente monitorata e supportata secondo necessità.
Dovresti essere preparato allo sviluppo dell'ipertensione intracranica. I livelli sierici di ammoniaca vengono utilizzati per monitorare la disfunzione neurologica. Tuttavia, non è noto se l’ammoniaca sia la principale tossina del sistema nervoso centrale o se sia solo uno dei tanti marcatori chimici. Gli steroidi sono stati usati per trattare alcune forme di epatite. Per ridurre il carico tossico sono state utilizzate la exsanguinotrasfusione e la plasmaferesi, ma non esistono prove convincenti che tali misure riducano la morbilità e la mortalità. Pazienti con alcune forme di insufficienza epatica acuta, comprese quelle derivanti da tossici e cause infettive, possono essere considerati candidati al trapianto di fegato.
Atresia biliare extraepatica
L'atresia del dotto biliare extraepatico si verifica con un'incidenza di 1 su 8.000-10.000 nati vivi. L'entità dell'atresia e i vari gradi di ostruzione o rottura del tratto biliare tra il duodeno e i rami prossimali dei dotti epatici variano da paziente a paziente. Il trattamento si basa sul numero effettivo di dotti biliari extraepatici ed è chirurgico (epaticodigiunostomia e portoenterostomia secondo Roux-en-Y). L'intervento di Kasai ha maggior successo nei pazienti operati prima dei 6-9 mesi di vita. Tuttavia, possono verificarsi molte complicazioni acute e croniche, tra cui insufficienza epatica, colangite ascendente e cirrosi epatica con ipertensione portale e vene varicose vene Nonostante queste complicazioni, l’operazione Kasai continua ad essere eseguita perché non sono disponibili abbastanza organi donatori idonei.
Trapianto di fegato
Miglioramenti nei farmaci immunosoppressori e metodi chirurgici il trattamento ha aumentato il successo del trapianto di fegato. Il successo del trapianto richiede la collaborazione tra chirurghi, gastroenterologi, anestesisti, immunologi e personale di terapia intensiva nei periodi perioperatori e postoperatori. La maggior parte dei problemi clinici che si presentano sono previsti. Poiché si verificano grandi perdite di sangue, è necessaria una terapia massiccia in sala operatoria. Di conseguenza, è necessario monitorare attentamente le condizioni del volume sanguigno, dei reni e del sangue/coagulazione. La necessaria immunosoppressione comporta il rischio di infezione sia da parte di microrganismi “normali” che opportunisti. Sono indicate le colture e la terapia antibiotica attiva precoce. L'ipertensione arteriosa, che si manifesta senza essere associata ad un aumento della pressione venosa centrale o della pressione capillare polmonare, è causata dall'uso di farmaci contro il rigetto del trapianto. Molti pazienti necessitano di una terapia antipertensiva attiva (idralazina, diazossido, captopril).
Supporto nutrizionale per bambini gravemente malati
Per ridurre la morbilità e la mortalità, è di fondamentale importanza un adeguato supporto nutrizionale per i bambini gravemente malati. Quando possibile, i fabbisogni calorici e minerali di questi pazienti dovrebbero essere soddisfatti. I bisogni nutrizionali dei bambini sani sono stati determinati, ma non sono ben compresi nei bambini gravemente malati; È difficile misurare il consumo di ossigeno e il bilancio di azoto al capezzale del paziente.
Può essere difficile ottenere una nutrizione adeguata a causa di disturbi intestinali, gravi restrizioni di liquidi dovute a malattie renali o del sistema nervoso centrale o ridotta tolleranza al glucosio. Tutti i metodi nutrizionali (enterale e parenterale) dovrebbero mirare a prevenire uno stato catabolico nell'organismo in crescita.
L’approccio più sicuro ed efficace è utilizzare la nutrizione enterale quando possibile. Sono disponibili molte miscele commerciali con varie fonti e quantità di proteine, grassi e carboidrati. Il fabbisogno proteico può essere soddisfatto con proteine totali, idrolizzati proteici o singoli aminoacidi. La proteina totale che ha il minor effetto osmotico ha il valore nutritivo più elevato. Tuttavia, può essere utilizzato solo nei bambini con normale funzionalità pancreatica e senza allergie. I bambini con allergie alle proteine, insufficienza pancreatica o gravi malattie della mucosa intestinale possono trarre beneficio dall'idrolizzato proteico. Tuttavia, queste miscele hanno un'elevata osmolarità. Le miscele di aminoacidi liberi vengono utilizzate in una dieta chimica prescritta limitata da esigenze specifiche o intolleranze.
L'alto contenuto calorico dei grassi lo rende una componente importante nel supporto nutrizionale. I trigliceridi a catena lunga forniscono circa 9 kcal/g, mentre i trigliceridi a catena media forniscono 8,3 kcal/g. Nonostante il loro alto contenuto calorico, i trigliceridi a catena lunga sono difficili da digerire. I trigliceridi a catena media vengono idrolizzati più rapidamente e diventano quasi liberi acidi grassi e glicerina. Inoltre, vengono adsorbiti anche in assenza di lipasi, grazie alla loro relativa solubilità in acqua e alle proprietà emulsionanti. Tuttavia, i trigliceridi a catena media non contengono acidi grassi essenziali. Pertanto, la dieta deve essere integrata con acido linoleico.

Nutrizione parenterale
La nutrizione parenterale viene utilizzata per i bambini che non tollerano la nutrizione enterale a causa di malattie respiratorie acute o patologie gastrointestinali e viene utilizzata anche come trattamento primario sindrome cronica intestino corto, morbo di Crohn e insufficienza renale.
Metodologia per l'attuazione della nutrizione parenterale nei bambini
Per la nutrizione endovenosa viene prescritto il 10%. soluzione acquosa destrosio (D10W) al ritmo di 1-1,5 dosi di mantenimento nell'arco di 24 ore. Il paziente viene attentamente monitorato per controllare la glicosuria, l'iperglicemia e l'edema. Se il carico di zucchero viene tollerato normalmente, può essere prescritta una soluzione di D10W con aminoacidi (PN-10). La soluzione D10W (con o senza aminoacidi) viene somministrata attraverso un catetere centrale o periferico. Le soluzioni concentrate devono essere somministrate attraverso cateteri centrali, poiché provocano la sclerosi delle vene periferiche. Se il catetere centrale è in posizione e il paziente ha tollerato 1,5 dosi di mantenimento di PN-10 o D10W, la dose di glucosio può essere aumentata al 20% e la velocità di infusione di glucosio può essere ridotta al livello di mantenimento. Il paziente deve aumentare di peso fino a raggiungere 1,5 volte il volume di supporto con PN. In generale, se un paziente è malnutrito (<0,80 веса к росту), объемы жидкости должны быть скорректированы в сторону понижения, чтобы составлять примерно 80% для нормальных детей того же веса. После первой недели пищевой реабилитации может использоваться регулярная жидкостная поддержка.
Nutrizione grassa parenterale per i bambini
Lipidi quando alimentati attraverso l'accesso venoso centrale.
La nutrizione endovenosa centrale dovrebbe contenere lipidi, necessari per prevenire lo sviluppo di carenze di acidi grassi essenziali e dovrebbe rappresentare almeno il 5-10% delle calorie totali. I seguenti volumi di emulsione lipidica forniscono una stima approssimativa della quantità di lipidi necessaria per prevenire la carenza di acidi grassi essenziali durante la nutrizione parenterale centrale:
5-10 ml/kg per i primi 10 kg;
2,5-5 ml/kg per i secondi 10 kg;
1,25-2,5 ml/kg per peso superiore a 20 kg.
I lipidi vengono solitamente somministrati diversi giorni dopo l’inizio della nutrizione parenterale. La tolleranza ai lipidi aumenta se il paziente ha avuto un periodo di nutrizione con adeguato apporto calorico. Gli acidi grassi possono compromettere la capacità del paziente di tollerare grandi dosi di destrosio. Dopo l’infusione dei lipidi, le concentrazioni dei lipidi nel plasma devono essere sempre monitorate.
Lipidi quando alimentati attraverso l'accesso venoso periferico.
Nella nutrizione endovenosa periferica (utilizzando emulsioni al 10% di grassi), la maggior parte delle calorie sono spesso costituite da lipidi perché è l'unico prodotto isosmolare con densità calorica sufficiente a supportare un apporto calorico significativo attraverso la vena periferica. Pertanto, una volta che il paziente che riceve nutrizione periferica raggiunge il volume massimo di PN-10, vengono aggiunti lipidi (emulsioni di grassi) ad un volume di 10 ml/kg/giorno, che viene regolato ad un dosaggio massimo di 40 ml/kg/giorno. Il contenuto calorico dei lipidi non deve superare il 60% delle calorie totali consumate. La clearance dei lipidi è facilitata dalla somministrazione continua per 24 ore.

Vantaggi e svantaggi della nutrizione parenterale periferica e centrale: ricambio energetico
La nutrizione parenterale periferica è una misura temporanea che raramente consente all'apporto calorico di superare i requisiti di mantenimento. Pertanto, per la crescita saranno disponibili solo poche calorie in più. La durata della nutrizione parenterale periferica dovrebbe essere limitata a 2 settimane. La nutrizione centrale, al contrario, può soddisfare sufficientemente il fabbisogno calorico e di azoto per la crescita e il mantenimento dell'organismo. Tuttavia, i cateteri centrali presentano un rischio di infezione.
Il fabbisogno energetico è la quantità di energia necessaria per il mantenimento, la crescita e l’attività. Tutta l’energia pulita che rimane dall’energia utilizzata per la manutenzione e l’attività è disponibile per la crescita. La proporzione delle calorie spese per la crescita (aumento del peso corporeo) è di almeno 5 cal/g di peso. La crescita normale è di circa 25-30 g/giorno nei primi 6 mesi di vita, di 10-15 g/giorno per i successivi 6 mesi e poi di circa 7-10 g/giorno. Utilizzando questi dati, è possibile regolare la nutrizione parenterale per ottenere una crescita normale o un moderato reintegro della carenza esistente. L'aumento di peso con un apporto calorico insufficiente (inferiore al fabbisogno di mantenimento) significa sempre che il bambino è edematoso. Se la terapia nutrizionale è intesa solo come mantenimento per 1-2 settimane, non è necessario preoccuparsi della crescita; la nutrizione periferica sarà adeguata. Se è necessario un significativo ricostituimento della massa muscolare o un supporto nutrizionale a lungo termine, è necessario soddisfare i reali fabbisogni nutrizionali per la crescita e l'attività.
Monitoraggio dei bambini che ricevono nutrizione parenterale totale
La quantità di sostanze consumate ed escrete e il peso corporeo devono essere valutati quotidianamente. Segni di ostruzione o occlusione e lividi nel sito del catetere (periferico o centrale) devono essere valutati regolarmente. La pelle e le mucose vengono esaminate per individuare segni di carenza di metalli. È necessario monitorare le dimensioni e la funzionalità del fegato; Nei pazienti sottoposti a nutrizione parenterale è stato osservato quanto segue:
colestasi intraepatica;
accumulo di grasso e glicogeno in eccesso;
funzionalità epatica migliorata.
Altri studi metabolici dovrebbero includere lo screening di routine di elettroliti, glucosio, azoto ureico nel sangue, creatinina e ammoniaca. Regolarmente, ma non spesso, è necessario controllare la quantità di proteine totali, albumina, emoglobina e trigliceridi.
Esodo
La sopravvivenza dei bambini dipende da un adeguato apporto nutrizionale. I bambini con un tratto gastrointestinale non funzionante possono sopravvivere con la nutrizione parenterale totale per molti anni, ma questa è ovviamente una misura temporanea. Nel corso del tempo, il rischio di complicanze derivanti dal cateterismo venoso centrale aumenta e l’accesso vascolare diventa limitato quando si utilizzano siti di cateterizzazione.

 Entrata
Entrata