Ensiklopedia besar minyak dan gas. Sifat fiziko-kimia lipid - muka surat 5
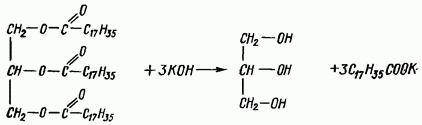
Lemak (sinonim: lemak neutral, trigliserida) - ester gliserol alkohol trihidrik dan asid lemak yang lebih tinggi atau sederhana, yang utama komponen lemak haiwan dan minyak sayuran, terdapat dalam semua tisu haiwan dan tumbuhan, adalah salah satu nutrien utama dalam pemakanan manusia. Lemak yang digunakan dalam pemakanan manusia lebih tepat dipanggil produk berlemak, kerana Sebagai tambahan kepada lemak itu sendiri, ia mengandungi bahan seperti lemak - lipid (sterol, fosfolipid, dll.). Sifat fizikokimia lemak ditentukan oleh sifat sisa asid lemak dalam molekulnya. G. mengandungi kuantiti yang ketara asid lemak tepu (palmitik, stearik, dll.) mempunyai takat lebur yang lebih tinggi; Lemak, yang mengandungi banyak asid lemak mono dan polyunsaturated, berada dalam keadaan cair pada suhu biasa dan dipanggil minyak. Minyak sayuran dicirikan kandungan yang tinggi asid lemak tak tepu (biji rami, rami, popi, minyak tung), dikenali sebagai minyak pengering, kerana di bawah pengaruh oksigen atmosfera mereka mempolimer dan mengeras.
Kegunaan biologi lemak ditentukan oleh kehadiran dalam komposisi vitamin larut lemak A, D dan E (tokoferol), asid lemak tak tepu (linoleik, linolenik, arakidonik), fosfolipid (lesitin, sphingomyelin), sterol (b-sitosterol). ), dsb., serta kemudahan penyerapan dalam saluran gastrousus. Mereka larut dengan baik dalam pelarut organik—benzena, kloroform, eter, karbon disulfida, eter petroleum, alkohol panas (lebih sukar dalam alkohol sejuk), aseton, dan tidak larut dalam air. Apabila surfaktan—detergen—ditambah kepada cecair dalam air, ia mampu membentuk emulsi lemak. Lemak neutral masuk ke dalam semua tindak balas kimia ciri ester (produk penggantian atom hidrogen dalam kumpulan OH mineral atau asid karboksilik) dan, terutamanya, dalam tindak balas saponifikasi, akibatnya gliserol dan asid lemak terbentuk daripada trigliserida. Saponifikasi lemak boleh berlaku melalui hidrolisis pemangkin dan melalui tindakan asid atau alkali pada lemak.
Untuk mendapatkan lemak dengan konsistensi yang lebih keras daripada minyak sayuran, yang digunakan sebagai asas lemak dalam pengeluaran marjerin, penghidrogenan (penghidrogenan) digunakan, i.e. ketepuan molekul minyak ini dengan hidrogen. Apabila disimpan, terutamanya dalam cahaya dan dengan akses bebas ke udara, lemak memperoleh rasa yang tidak menyenangkan - mereka menjadi tengik. Telah ditetapkan bahawa dalam ketengikan J. peranan utama memainkan pengoksidaan asid lemak tak tepu dengan oksigen atmosfera. Peroksida yang terhasil terurai untuk membentuk aldehid. Pengoksidaan asid lemak tak tepu kepada asid b-keto juga boleh berlaku (kononnya ketengikan lemak keton). Kriteria bagi sifat-sifat lemak ialah nombor asid, nombor saponifikasi, nombor iodin dan nombor peroksida. Nombor asid (AN) digunakan untuk menganggarkan jumlah asid lemak yang terkandung dalam lemak sebagai bendasing dalam keadaan bebas; secara berangka ia adalah sama dengan bilangan miligram kalium kaustik KOH yang digunakan untuk meneutralkan satu gram cecair.
Nombor saponifikasi (SN) ialah bilangan miligram kalium hidroksida yang digunakan untuk meneutralkan semua asid lemak (baik bebas dan dalam trigliserida) yang terkandung dalam 1 g lemak; PO digunakan untuk menilai jumlah bilangan asid lemak dalam lemak yang dikaji. Nilai ATAU lemak haiwan utama (daging lembu, kambing, babi) adalah hampir sama - 191-206. Nilai iodin (IV) digunakan untuk menentukan jumlah keseluruhan sebatian tak tepu, hadir dalam lemak, dan secara berangka sama dengan jumlah iodin yang ditambah dalam keadaan standard kepada 100 bahagian mengikut berat lemak. CN lemak daging lembu ialah 32-47, lemak kambing 35-46, lemak babi 46-66. Kandungan relatif peroksida asid lemak dalam lemak yang dikaji ditunjukkan oleh nilai peroksida (PN), yang ditentukan oleh pentitratan. iodin percuma, dikeluarkan apabila kalium iodida ditambah kepada lemak; IF dinyatakan sebagai peratusan iodin mengikut jisim. Penyediaan lemak yang dilabelkan dengan radionuklid (paling kerap iodin radioaktif) digunakan untuk diagnostik radioisotop, contohnya, untuk penyakit saluran gastrousus. Persediaan diagnostik sedemikian ialah 131I-gliserol trioleat (131I-triolein) dan 131I-minyak sayuran (bunga matahari, jagung dan zaitun).
Diagnosis gangguan proses pencernaan dan penyerapan lemak menggunakan lemak yang mengandungi label radioaktif adalah berdasarkan fakta bahawa lemak neutral, sebelum diserap dalam usus, mengalami pecahan di bawah tindakan lipase pankreas, manakala asid lemak diserap secara langsung. Oleh itu, dalam penyakit pankreas, penyerapan lemak neutral, sebagai contoh, 131I-triolein, terjejas dengan penyerapan normal asid 131I-oleik, dan dalam penyakit usus, penyerapan kedua-dua triolein dan asid oleik bebas berkurangan. Mengkaji penyerapan asid lemak berlabel berfungsi sebagai kaedah yang mudah dan boleh dipercayai untuk mengenal pasti steatorrhea; ia memungkinkan untuk membezakan steatorrhea asal pankreatogenik daripada steatorrhea, perkembangannya disebabkan oleh penyerapan trigliserida dan asid lemak terjejas dalam penyakit usus kecil.
Patologi metabolisme lemak dalam beberapa penyakit dikesan dengan menentukan komposisi kuantitatif dan kualitatif lipid dalam darah, termasuk. lemak neutral Biasanya, serum darah mengandungi sehingga 2.3 mmol/l (200 mg/100 ml) lemak neutral, atau trigliserida. Kandungan lemak neutral dalam darah (lipemia) berbeza dengan ketara bergantung pada masa pengambilan makanan, terutamanya makanan berlemak. Dalam darah orang yang sihat hiperlipemia diperhatikan 2-3 jam selepas pemuatan lemak, mencapai maksimum selepas 4-6 jam, dan selepas 8-9 jam kandungan lemak kembali ke nilai asalnya. Oleh itu, penentuan diagnostik jumlah trigliserida dan lipid lain dalam darah perlu dilakukan semasa perut kosong. Peningkatan kepekatan lemak neutral dalam serum darah menunjukkan penindasan mekanisme penggunaan lemak.
Hiperlipemia diperhatikan dalam obesiti, hepatitis, aterosklerosis, nefrosis, diabetes mellitus dan sekatan sistem fagosit mononuklear. Ia adalah gejala biokimia yang tidak menguntungkan, kerana kandungan meningkat Lemak dalam serum darah membantu menyekat sintesis asid lemak dan mengalihkan sebahagian laluan untuk penggunaan dana asetil-KoA selular ke arah biosintesis kolesterol. Terutamanya tidak menguntungkan dalam hal ini adalah peningkatan dalam kepekatan trigliserida yang mengandungi sisa-sisa asid lemak tepu dalam molekulnya. Lemak neutral (trigliserida) ditentukan di klinik menggunakan kaedah Carlson-Ignatovskaya, yang berdasarkan pengukuran jumlah gliserol yang dikeluarkan akibat hidrolisis trigliserida. Keperluan seseorang untuk hidup bergantung pada umur, watak aktiviti buruh Dan keadaan iklim. Secara purata, keperluan untuk lemak adalah 80-100 g sehari. Pada usia tua, serta dengan rendah aktiviti fizikal dan pekerjaan dengan kerja mental, keperluan untuk pakaian berkurangan Dalam iklim sejuk, keperluan untuk pakaian meningkat. Penggunaan lemak haiwan yang berlebihan adalah faktor risiko untuk perkembangan aterosklerosis. Kekurangan lemak dalam makanan atau pelanggaran berterusan nisbah optimumnya membawa kepada pelbagai gangguan metabolik dan tenaga dan menyebabkan beberapa penyakit.
Konsep umum.
Lemak adalah ester gliserol dan asid lemak berat molekul tinggi.
Lemak mengandungi banyak asid lemak tepu (atau tepu) dan tak tepu (atau tak tepu). Antara asid tepu, asid stearik (C17H35COOH) dan palmitik (C15H31COOH) adalah lebih biasa. Daripada asid lemak tak tepu, peranan utama adalah oleik (C17H33COOH), linoleik (C17H31COOH) dan linolenik (C17H29COOH), asid arakidonik (C19H31COOH) juga mempunyai kepentingan fisiologi yang besar. Asid lemak tak tepu dicirikan oleh kehadiran ikatan berganda: molekul asid oleik mengandungi satu ikatan berganda, molekul asid linoleik mengandungi dua, asid linolenik mengandungi tiga, dan asid arakidonik mengandungi empat. Oleh kerana kehadiran ikatan rangkap, asid tak tepu sangat reaktif. Asid linoleik, linolenik dan arakidonik (dipanggil iolinenik) tidak disintesis dalam badan manusia dan mesti dibekalkan dengan makanan. Kekurangan asid ini dalam makanan menyebabkan gangguan metabolik yang serius, yang hilang apabila mengambil makanan yang mengandungi asid lemak tak tepu. Oleh itu, sebatian ini diklasifikasikan sebagai bahan yang mempunyai kesan vitamin (vitamin F). Asid linoleik dan linolenik terdapat dalam minyak sayuran (biji rami, bunga matahari, dll.), Asid arakidonik - dalam minyak hati ikan, mentega dan beberapa jenis marjerin.
Minyak sesetengah tumbuhan tropika juga mengandungi asid lemak kitaran (chaulmogroic, hydnocarp, dll.).
Reaksi kualitatif terhadap lemak.
Pembentukan noda minyak. Setitik minyak disapu dengan batang kaca pada sekeping kertas. Noda terbentuk yang tidak hilang apabila dipanaskan.
Keterlarutan lemak. Reagen: a) minyak sayuran(bunga matahari, linen, kapas atau lain-lain); b) lemak pepejal (kambing, daging lembu); c) dietil eter; d) aseton; e) etil alkohol; e) air suling.
Letakkan dua baris tabung uji, 4 dalam setiap satu. Beberapa titis minyak sayuran ditambah ke dalam tabung uji baris pertama, dan sekeping lemak pepejal ditambah ke tabung uji baris kedua. 2 ml air suling dituangkan ke dalam tabung uji pertama setiap baris, jumlah dietil eter yang sama ke dalam yang kedua, aseton ke dalam yang ketiga, dan alkohol ke dalam yang keempat. Semua tabung uji digoncang dan keterlarutan lemak dalam pelbagai pelarut diperhatikan. Adalah disyorkan untuk memanaskan tabung uji dengan alkohol dalam tab mandi air. Catatkan keputusan eksperimen.
Pengemulsian minyak berlemak. Reagen minyak sayuran; b) natrium karbonat, larutan 2%; c) sabun, larutan 2%; d) hempedu; e) air suling.
Masukkan 5 titis minyak ke dalam empat tabung uji. Tambah 2 ml air suling ke dalam tabung uji pertama, 2 ml larutan 2% natrium karbonat (soda) ke dalam tabung kedua, jumlah larutan sabun 2% yang sama dengan yang ketiga, air dan beberapa titik hempedu ke dalam tabung uji. keempat. Semua tabung uji digoncang dan pembentukan emulsi minyak yang tidak stabil dalam air, yang cepat berstrata apabila berdiri, diperhatikan dalam tabung uji pertama, dan selebihnya - emulsi yang stabil akibat tindakan pengemulsi tambahan, yang terserap. di lapisan luar titisan lemak dan mengurangkan ketegangan permukaannya.
Reaksi akrolein. Menggunakan ujian akrolein, kehadiran gliserol dalam lemak ditentukan. Apabila lemak dipanaskan dengan kalium sulfat atau asid borik berasid, dua molekul air dipisahkan daripada molekul gliserol dan aldehid akrilik, atau akrolein, terbentuk, yang mempunyai bau merengsa tajam (lemak terbakar):
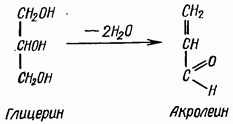
Gliserin Akrolein
Reagen: a) minyak sayuran atau lemak haiwan; b) lilin lebah; c) kalium sulfat berasid atau natrium, kristal; d) asid borik, kristal.
Beberapa titik minyak sayuran atau sekeping lemak haiwan ditambah ke dalam tabung uji kering, sedikit kalium sulfat (atau natrium) berasid atau serbuk asid borik ditambah dan dipanaskan dengan teliti. Wap akrolein putih muncul, yang mempunyai bau pedas. Ulangi tindak balas dengan lilin - akrolein tidak terbentuk, kerana gliserin bukan sebahagian daripada lilin.
Saponifikasi lemak. Apabila lemak berinteraksi dengan alkali, ia terhidrolisis untuk membentuk garam asid lemak yang lebih tinggi (sabun) dan gliserol. Garam natrium ialah sabun pepejal, manakala garam kalium ialah sabun cair. Tindak balas mengikut persamaan
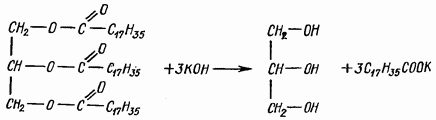
Reagen: a) minyak sayuran atau lemak haiwan; b) kalium hidroksida, larutan alkohol 30%; c) air suling.
Tambah 0.5 ml minyak sayuran atau kira-kira 0.5 g lemak haiwan ke dalam tabung uji lebar dan tambah 10 ml larutan alkohol kalium hidroksida. Tabung uji ditutup dengan penyumbat dengan penyejuk udara dan dipanaskan dalam mandi air mendidih selama 30 minit, selepas itu air panas dituangkan ke dalam tabung uji dan sabun dilarutkan di dalamnya.
Pembebasan asid lemak bebas. Reagen: a) larutan sabun (lihat kerja sebelumnya); b) asid hidroklorik (1:1 mengikut isipadu).
Kepada 5 ml larutan sabun tambahkan 1-2 ml larutan asid hidroklorik. Apabila asid kuat berinteraksi dengan sabun, asid lemak bebas dibebaskan dan terapung ke permukaan cecair. Tindak balas berlaku mengikut persamaan berikut:
Pembentukan sabun tidak larut. Garam kalsium dan magnesium asid lemak tidak larut dalam air.
Reagen: a) larutan sabun (lihat kerja "Saponifikasi lemak"); b) kalsium klorida, larutan 5-10%.
Tambah 1 ml larutan kalsium klorida kepada 2-3 ml larutan sabun kalium. Mendakan kalsium stearat yang tidak larut dalam air.
Ujian untuk asid lemak tak tepu. Asid lemak tak tepu mampu menambah halogen di tapak ikatan rangkap:
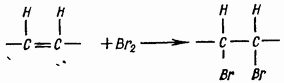
Reagen: a) minyak sayuran; b) air bromin (disimpan di bawah draf!); c) dietil eter atau kloroform.
1-2 ml minyak dituangkan ke dalam tabung uji, dibubarkan dalam 2-3 ml dietil eter atau kloroform, 1-2 titis air bromin ditambah dan digoncang. Warna kuning kecoklatan air bromin hilang, menunjukkan kehadiran asid tak tepu.
Penentuan kuantitatif lemak. Banyak kaedah untuk menentukan kandungan lemak dalam bahan biologi adalah berdasarkan keupayaan lipid untuk larut dalam pelarut organik (dietil dan petroleum eter, tetraklorida
karbon, dikloroetana, kloroform, dll.). Apabila diekstrak dengan pelarut organik, bukan sahaja lemak, tetapi juga asid lemak bebas, fosfolipid, sterol, lilin, minyak pati, pigmen (contohnya, klorofil) dan beberapa bahan lain masuk ke dalam larutan, oleh itu produk yang diperolehi sebagai hasil daripada analisis dipanggil "lemak kasar" atau "jumlah lipid". Untuk tujuan praktikal, penunjuk ini biasanya mencukupi, tetapi jika perlu, lebih banyak definisi yang tepat"lemak sejati" adalah perlu untuk memeriksa kandungan fosfolipid (fosforus) dalam sampel bahan yang berasingan, minyak pati(melalui penyulingan wap), asid lemak bebas (kaedah titrimetri), dsb. dan membuat pelarasan yang sesuai kepada keputusan analisis.
Kami membentangkan kaedah untuk menentukan "lemak mentah" dalam biji minyak (menurut S. V. Rushkovsky), yang telah menemui aplikasi yang luas dalam amalan makmal.
Reagen dan bahan; a) dietil eter. Eter anhydrous digunakan untuk pengekstrakan lemak. Kalsium klorida terkalsin atau kapur (kalsium oksida) ditambah ke dalam botol dengan eter komersial. Bekas itu dimeteraikan dengan penyumbat gabus, di mana tiub dengan kalsium klorida terkalsin dimasukkan. Selepas 1-2 hari, eter disalirkan dan bahagian baru kapur cepat atau kalsium klorida ditambah kepadanya. Selepas 6-8 jam, eter dituangkan ke dalam bekas, di bahagian bawahnya diletakkan kepingan logam natrium. Eter juga mestilah bebas daripada peroksida. Untuk melakukan ini, tambahkan larutan kalium permanganat dan 10 ml larutan 40% kalium hidroksida atau natrium hidroksida kepada 1 liter eter, campuran itu digoncang dengan teliti dan diletakkan di tempat yang gelap selama 20-24 jam, selepas itu ia dipisahkan dalam corong pemisah. Lapisan bawah, berair, diasingkan, dan bahagian atas, halus, dicuci beberapa kali dengan air suling dan kemudian didehidrasi seperti yang diterangkan di atas. Perhatian! Dietil eter sangat mudah terbakar, wapnya membentuk campuran letupan dengan udara, jadi semua kerja mesti dijalankan dengan mematuhi langkah keselamatan kebakaran. Adalah dinasihatkan untuk menggantikan dietil eter dengan pelarut yang tidak mudah terbakar, seperti karbon tetraklorida atau kloroform;
b) natrium fosfat tertukar ganti, anhydrous, atau natrium sulfat, anhydrous. Garam kristal dikeringkan selama 6-8 jam pada suhu 100-105° C. Natrium sulfat dikalsinkan dalam relau meredam untuk rami, rami, bunga matahari, biji sesawi dan biji bijan.
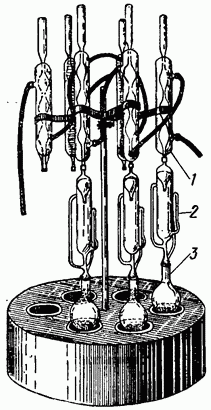
nasi. 11. Radas pengekstrakan Soxhlet.
Peralatan: a) Radas pengekstrakan Soxhlet (Gamb. 11). Ia terdiri daripada tiga bahagian, dikisar antara satu sama lain: penyejuk bola atau lingkaran 1, pengekstrak 2 dan kelalang penerima 3.
Ambil 2-3 sampel benih tetapi 2-5 g (bergantung kepada kandungan minyak yang dijangkakan). Sampel dipindahkan ke dalam mortar porselin kering dan dikisar dengan natrium sulfat kontang atau natrium fosfat tersubstitusi sehingga jisim serbuk homogen diperolehi. Garam diambil tiga kali lebih banyak berbanding dengan berat.
Jisim yang dikisar dengan teliti dipindahkan secara kuantitatif ke dalam beg kertas turas, dikeringkan kepada berat tetap. Beg itu dibalut seperti serbuk di farmasi, ditimbang pada neraca analitik dan dipindahkan ke pengekstrak radas Soxhlet.
Nota. Anda boleh meletakkan 4-6 sachet dalam pengekstrak.
Eter (atau pelarut lain) dituangkan ke dalam kelalang penerima ke dalam bekas, selepas itu ia disambungkan kepada pengekstrak. Begitu banyak eter dituangkan ke dalam pengekstrak supaya parasnya menutupi beg dan hampir mencapai bahagian atas sifon, kemudian menggunakan bahagian nipis ia disambungkan ke peti sejuk dan radas diletakkan di dalam tab mandi air sejuk. Bahan diselitkan dalam pelarut
sekurang-kurangnya 3-4 jam dan hanya selepas itu hidupkan sumber pemanasan.
Nota. Peranti Soxhlet hendaklah dipasang dalam hud wasap. Kami sekali lagi menekankan keperluan untuk pematuhan yang teliti terhadap semua langkah keselamatan kebakaran. Semasa menuang eter, matikan semua peralatan elektrik di makmal.
Wap eter daripada kelalang penerima mengalir melalui tiub lebar ke dalam peti sejuk, di mana ia terpeluwap, dan titisan pelarut mengalir ke dalam pengekstrak, mengekstrak lemak daripada biji tanah. Sebaik sahaja tahap eter mencapai tepi atas tiub sifon, ia akan serta-merta mula mengalir ke dalam kelalang penerima. Oleh itu, proses pengekstrakan berterusan. Dietil eter mendidih pada suhu 34-35 ° C, jadi perlu menyesuaikan pemanasan supaya tidak lebih daripada 8-10 longkang pelarut melalui tiub sifon berlaku dalam masa satu jam.
Pengekstrakan lemak diteruskan selama 5-6 jam (tidak dikira masa infusi), selepas itu beg dengan bahan bebas lemak dikeluarkan dari pengekstrak, dikeringkan di atas kaca dalam hud wasap (sehingga eter menguap) dan dikeringkan (ditimbang). botol) pada 100-105 ° C sehingga berat malar. Kandungan minyak dalam biji benih (sebagai peratusan bahan kering) dikira dengan mengetahui berat beg sebelum dan selepas pengekstrakan, serta berat beg kosong. Ambil purata 3-4 penentuan.
Penentuan parameter kimia lemak.
Lemak semulajadi sangat heterogen dalam komposisinya. Ia terdiri daripada campuran trigliserida pelbagai asid lemak tepu dan tak tepu. Selain itu, ia juga mengandungi mono- dan digliserida, asid lemak bebas, pigmen, vitamin larut lemak, dan beberapa campuran bahan protein. Lemak neutral biasanya disertai dengan lipoid (fosfatida, sterol, steroid, dll.).
Lemak sayuran (biasanya dipanggil minyak) dicirikan oleh konsistensi cecair. Mereka terdiri terutamanya daripada asid tak tepu. Mentega koko dan mentega kelapa adalah pepejal.
Lemak asal haiwan kebanyakannya pepejal, kerana ia terdiri terutamanya daripada gliserida asid lemak tepu. Lemak haiwan cair
Lemak dicirikan oleh beberapa penunjuk kimia. Yang utama ialah: nombor asid, nombor saponifikasi, nombor eter, nombor iodin.
Nota. Untuk lebih lanjut ciri terperinci sifat kimia zhnrov juga ditentukan oleh kandungan asid meruap (larut dan tidak larut dalam air), asid oksik (nombor asetil), nombor rhodana dan heksabromik dan beberapa penunjuk lain, yang pertimbangannya bukan skop bengkel kami.
Apabila lemak disimpan di bawah pengaruh oksigen atmosfera, kelembapan dan cahaya matahari, dengan penyertaan pemangkin-enzim organik, ia merosot dan menjadi tengik. Minyak sayuran yang kaya dengan asid tak tepu menjadi tengik lebih cepat daripada lemak pepejal. Tahap kestabilan lemak semasa penyimpanan dicirikan oleh nilai peroksida dan kandungan aldehid. Ini sebahagian besarnya dibuktikan oleh nombor asid, kerana semasa kerosakan, pecahan hidrolitik trigliserida berlaku dan asid lemak bebas dibebaskan.
Nombor asid. Nombor asid ialah bilangan miligram kalium hidroksida yang diperlukan untuk meneutralkan asid lemak bebas yang terkandung dalam 1 g lemak.
Reagen: a) kalium hidroksida, larutan alkohol 0.1 N;
b) campuran etil alkohol dengan dietil eter (1:1);
c) fenolftalein, larutan alkohol 1%; d) timol-ftalein, larutan alkohol 1%.
3-5 g lemak ditimbang ke dalam kelalang kon kering (kapasiti 250 ml). Sampel dibubarkan dalam 50 ml campuran alkohol dan eter pra-neutralkan.
Nota. Campuran alkohol dan eter dineutralkan dengan larutan alkohol 0.1 N kalium kaustik (dengan kehadiran 3-4 titis larutan fenolftalein) sehingga ia menjadi sedikit merah jambu, dan barulah ia dituangkan ke dalam kelalang dengan sebahagian daripada cecair.
Larutan lemak dititrasi dengan larutan alkohol 0.1 N kalium hidroksida (phenolphthalein sebagai penunjuk) sehingga warna merah jambu, tidak hilang dalam masa 0.5-1 minit.
Apabila menentukan bilangan asid lemak berwarna gelap, 1% alkohol digunakan dan bukannya fenolftalein.
larutan thymolphthalein (dalam persekitaran berasid ia tidak berwarna, dalam persekitaran alkali ia berwarna biru).
Nombor asid kepekatan dikira menggunakan formula
![]()
dengan c ialah jumlah 0.1 N larutan alkohol kalium hidroksida yang digunakan untuk pentitratan sampel lemak, ml; k - faktor pembetulan kepada titer larutan KOH 0.1 N; 5.611 - titer larutan KOH 0.1 N tepat; n - berat lemak, g.
Untuk mencirikan keasidan minyak sayuran, sebagai tambahan kepada nombor asid, peratusan asid oleik bebas O sering dikira menggunakan formula.
![]()
di mana k.n ialah nombor asid minyak, mg.
Nombor saponifikasi. Nombor saponifikasi menunjukkan berapa banyak miligram kalium hidroksida mesti digunakan untuk meneutralkan kedua-dua asid bebas dan terikat (terester) yang terkandung dalam 1 g lemak.
Reagen: a) minyak sayuran atau lemak haiwan; b) kalium hidroksida, larutan alkohol 0.5 N: 29-30 g kalium hidroksida berbutir dilarutkan dalam 25-30 ml air, selepas itu beberapa mililiter larutan barium klorida 35-40% dan larutan dalam kelalang volumetrik liter ditambah untuk mendakan karbonat membawa kepada tanda dengan etil alkohol - diperbetulkan. Simpan dalam botol kaca oren yang tertutup rapat. Untuk melindungi daripada penembusan karbon dioksida dari udara, kelalang dilengkapi dengan tiub kalsium klorida dengan kapur soda; c) asid hidroklorik, larutan 0.5 N; d) fenolftalein, larutan alkohol.
Kelalang kon (kapasiti 250 ml) ditimbang pada neraca analitik, kemudian kira-kira 2 g minyak sayuran atau lemak haiwan ditambah kepadanya dan ditimbang semula. Berat lemak ditentukan berdasarkan perbezaan. Menggunakan pipet dengan mentol getah, tuangkan 25 ml larutan alkohol KOH 0.5 N ke dalam kelalang, tutup dengan penyumbat refluks dan panaskan dalam tab mandi air selama 35-40 minit, goncangkan kandungan kelalang dari semasa ke semasa . Apabila menyabunkan lemak, seseorang tidak sepatutnya membenarkan ganas
air mendidih di dalam tab mandi, yang boleh menyebabkan cecair berbuih di dalam kelalang dan masuk ke penyumbat. Menjelang akhir proses saponifikasi, larutan dalam kelalang menjadi homogen, telus, tanpa titisan lemak.
Larutan sabun panas di dalam kelalang dititrasi dengan asid hidroklorik 0.5 N (phenolphthalein sebagai penunjuk) sehingga warna merah jambu berubah warna. Secara selari, eksperimen kawalan dijalankan dengan jumlah larutan alkohol KOH 0.5 N yang sama, tetapi tanpa menambah lemak. Eksperimen kawalan adalah perlu untuk memeriksa titer larutan KOH, kerana disebabkan oleh penembusan separa karbon dioksida dalam udara dan pengoksidaan etil alkohol, titer mungkin berubah.
Nombor saponifikasi o. dikira dengan formula
![]()
dengan c ialah jumlah larutan asid hidroklorik 0.5 N yang digunakan untuk pentitratan eksperimen kawalan (“buta”), ml; - jumlah larutan asid hidroklorik 0.5 N yang digunakan untuk pentitratan sampel ujian, k - faktor pembetulan kepada titer kira-kira 0.5 N larutan alkohol KOH; 28.055 - titer larutan KOH tepat 0.5 N (1 ml larutan mengandungi 28.055 mg KOH); n - berat lemak, g.
Nombor penting. Nombor eter ialah bilangan miligram kalium hidroksida yang diperlukan untuk meneutralkan asid lemak yang terikat sebagai ester dalam 1 g lemak.
Nombor penting e. jam ditentukan dengan pengiraan dengan menolak nombor asid daripada nombor saponifikasi:
Oleh itu, nombor saponifikasi ialah hasil tambah nombor asid dan ester.
Penentuan jumlah gliserol dalam lemak.
Penentuan kimia kandungan gliserol dalam lemak adalah agak intensif buruh dan memakan masa. Kaedah pengiraan memberikan hasil yang agak baik. Mengetahui bilangan halus lemak, anda boleh mengira kandungan gliserol, dengan mengambil kira bahawa untuk melepaskan satu molekul gliserol, tiga molekul kalium hidroksida mesti dimakan.
Peratusan gliserol dalam lemak g dikira menggunakan formula
![]()
di mana 92.06 ialah berat molekul gliserol; e. h. - nilai penting lemak; 56.11 - berat molekul kalium hidroksida.
Nombor iodin.
Maklumat am. Nombor iodin menunjukkan bilangan gram iodin yang ditambah kepada 100 g lemak. Ia menunjukkan kandungan kuantitatif asid tak tepu dalam lemak, yang membolehkan kita menilai ketahanannya terhadap pengoksidaan, pempolimeran dan transformasi lain. Nombor iodin adalah ciri penunjuk bagi setiap jenis lemak segar.
Kimia proses penambahan halogen diterangkan di atas (lihat "Ujian untuk asid lemak tak tepu"). Perlu ditekankan bahawa iodin melekat terutamanya pada ikatan berganda, manakala halida yang lebih reaktif - klorin dan bromin - juga boleh menggantikan atom hidrogen dalam radikal hidrokarbon asid.
Yang paling tepat ialah penentuan nombor iodin oleh Güblü, bagaimanapun, ia dikaitkan dengan penggunaan reagen yang sangat beracun - sublimat dan oleh itu tidak boleh disyorkan untuk kerja amali pelajar. Kami menerangkan kaedah yang lebih mudah dan cepat untuk menentukan nombor iodin, penggunaannya tidak melibatkan penggunaan merkuri klorida. Kaedah ini mempunyai ketepatan yang cukup memuaskan.
Penentuan nombor iodin dengan iodin bromida (mengikut Hanus). Iodin bromida terbentuk melalui tindak balas iodin dengan bromin dalam larutan asid asetik.
Iodin bromida secara kuantitatif menambah kepada asid lemak tak tepu di tapak ikatan berganda.
Lebihan iol bromida yang tidak masuk ke dalam tindak balas bertindak balas dengan kalium iodida mengikut persamaan
Iodin yang dibebaskan dititrasi dengan tiosulfat
Reagen: a) minyak sayuran; b) Reagen Hanus: 13 g iodin kristal dilarutkan dalam 100 ml ais sejuk asid asetik(dalam kelalang volumetrik dengan kapasiti . Tambah 8.2 g bromin ke dalam larutan dan bawa ke 1 liter dengan asid asetik glasier. Simpan dalam kelalang kaca oren dengan penyumbat tanah. Larutan disediakan oleh pembantu makmal (dalam hud wasap!); c) kalium iodida, 20% - larutan ny. Disediakan segera sebelum penentuan; d) natrium tiosulfat (hiposulfit, natrium sulfat), larutan 0.1 N; e) kanji, larutan 1%; e) kloroform.
Dalam kelalang kon kering atau kelalang dengan penyumbat tanah dengan kapasiti 250-300 ml, timbang 0.2-0.3 g minyak pada neraca analitik dan larutkan dalam 10 ml kloroform. Tambah 10 ml kloroform tanpa minyak (“percubaan buta”) ke dalam kelalang atau kelalang lain yang serupa Tambah 25 ml reagen Hanus ke kedua-dua kelalang daripada buret (dengan stopcock kaca). Bejana ditutup rapat dengan penyumbat yang direndam dalam larutan kalium iodida. Kandungan bekas digoncang dengan teliti, selepas itu bekas diletakkan di tempat yang gelap selama 1-1.5 jam Selepas masa yang ditetapkan, 10 ml larutan kalium iodida 20% dan 50 ml air ditambah kepada kedua-dua kapal. dan iodin yang dibebaskan dititrasi dengan larutan natrium tiosulfat 0.1 N sehingga berwarna kuning sedikit, kemudian tambahkan 10-12 titik larutan kanji dan teruskan titrasi sehingga larutan berubah warna sepenuhnya.
Apabila mengira, diambil kira bahawa 1 ml larutan natrium tiosulfat 0.1 N sepadan dengan 1 ml larutan iodin 0.1 N. Nombor iodin dan. jam dikira menggunakan formula
di mana c ialah jumlah larutan tiosulfat 0.1 N yang digunakan untuk pentitratan sampel kawalan (“percubaan buta”), ialah jumlah larutan tiosulfat 0.1 N,
digunakan semasa titrasi prototaip, k - faktor pembetulan kepada titer kira-kira 0.1 N larutan tiosulfat; 0.01269 - titer larutan tiosulfat berkenaan dengan iodin; n - berat minyak, g.
Nombor peroksida.
Maklumat am. Asid lemak tak tepu mudah terdedah kepada pengoksidaan. Proses ini berlaku di bawah pengaruh oksigen atmosfera, kelembapan, cahaya dan dimangkinkan oleh enzim lipoxygenase (lipoxidase).
Peroksida ialah sebatian yang tidak stabil. Mereka mudah terurai dengan pembentukan oksida dan pembebasan oksigen atom. Oksigen atom pula berfungsi sebagai sumber pembentukan ozon dan hidrogen peroksida.
Selepas itu, peroksida dan oksida ditukar kepada asid hidroksi.
Ozon yang dibebaskan mengoksidakan molekul baru asid tak tepu. Sebatian yang tidak stabil terbentuk, ozonida, yang terurai secara hidrolitik, bertukar menjadi aldehid.
Inilah sebabnya mengapa menentukan kandungan peroksida dan aldehid boleh sangat membantu dalam menilai kualiti minyak sayuran.
Penentuan nilai peroksida. Penentuan kuantitatif peroksida dalam minyak sayuran adalah berdasarkan tindak balas pembebasan iodin oleh peroksida daripada kalium iodida dalam persekitaran berasid
Iodin dititrasi dengan larutan tiosulfat.
Reagen: a) minyak sayuran (sebaik-baiknya tengik); b) asid asetik, glasier; c) kloroform, kimia tulen (sebaik-baiknya untuk anestesia); d) kalium iodida, larutan tepu. Disediakan sebelum digunakan; e) natrium tiosulfat (hiposulfit, natrium sulfat), larutan 0.002 N. Sediakan sebelum digunakan daripada larutan 0.1 N: tambahkan 5 ml larutan 0.1 N ke dalam kelalang volumetrik 250 ml menggunakan pipet dan
bawa ke tanda dengan air rebus (dan kemudian disejukkan hingga 20 ° C) air suling; f) kanji, larutan 0.5%.
Dalam kelalang kon atau kelalang dengan penyumbat tanah berkapasiti 200 ml, timbang (pada neraca analitik) kira-kira 2 g minyak. Sampel dibubarkan dalam 20 ml campuran asid asetik glasier dan kloroform (2:1 mengikut isipadu), 5 ml larutan tepu kalium iodida ditambah, bekas itu ditutup dengan penyumbat dan diletakkan di tempat yang gelap untuk 10 minit, selepas itu 50 ml air suling ditambah dan produk yang terhasil dititrasi iodin 0.002 N larutan tiosulfat (penunjuk - kanji). Pada masa yang sama, penentuan kawalan (tanpa minyak) juga dijalankan.
Nombor peroksida (bilangan gram iodin yang dikeluarkan oleh peroksida yang terkandung dalam 100 g minyak) dikira menggunakan formula
di mana c ialah jumlah larutan tiosulfat 0.002 N yang digunakan semasa penentuan kawalan, - jumlah larutan tiosulfat 0.002 N yang digunakan semasa pentitratan sampel ujian, ml; k ialah faktor pembetulan larutan tiosulfat; 0.0002538 - titer larutan tiosulfat 0.002 N untuk iodin (1 ml larutan sepadan dengan 0.0002538 g iodin); n - berat minyak, g.
Tindak balas kualitatif untuk aldehid (dengan reagen Schiff).
Salah satu yang paling spesifik ialah tindak balas aldehid dengan asid fuchsinous (reagen Schiff). Larutan asid fuksulfur yang tidak berwarna, di bawah pengaruh aldehid, mengambil warna merah-ungu atau biru-ungu.
Reaksi berjalan mengikut skema berikut:
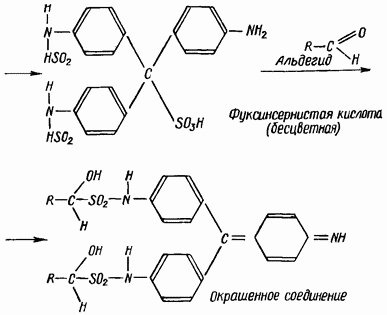
Reagen. Reagen Schiff; boleh disediakan dengan dua cara: a) 0.5 g fuchsin dilarutkan dalam 500 ml air dan ditapis. 500 ml air tepu dengan sulfur dioksida. Kedua-dua larutan dituangkan bersama-sama dan dibiarkan selama 10-12 jam Simpan di tempat yang gelap; b) tuangkan 30 ml larutan alkohol 0.1% fuchsin ke dalam kelalang volumetrik 250 ml, tambah 15 ml 32% larutan akueus air natrium sulfida. Kandungan kelalang digaul dengan teliti dan dibiarkan selama 1 jam, selepas itu 16 ml asid sulfurik cair (1:3) ditambah dan ditambah sehingga tanda dengan 50% etil alkohol. Simpan dalam botol kaca gelap atau tempat gelap. Apabila mengkaji minyak, lebih baik menggunakan reagen yang disediakan mengikut kaedah kedua.
Tuangkan 5-6 ml minyak ke dalam tabung uji, tambah 2-3 ml reagen Schiff dan goncang. Jika aldehid ada, cecair akan bertukar menjadi biru-ungu atau merah-ungu. Pewarnaan maksimum berkembang selepas 15-16 minit. Jika warna tidak muncul selepas 20 minit. selepas permulaan eksperimen, ini menunjukkan ketiadaan aldehid dalam minyak.
Pengasingan dan pengenalpastian asid lemak tepu yang lebih tinggi menggunakan kromatografi kertas.
Maklumat am. Menggunakan kaedah yang diterangkan
adalah mungkin untuk memisahkan dan mengenal pasti asid lemak tepu yang lebih tinggi, yang mengandungi daripada 12 hingga 24 atom karbon.
Prosedur am untuk mengasingkan bahan organik di atas kertas diterangkan di atas (lihat "Kromatografi pembahagian asid amino di atas kertas").
Untuk kromatografi asid lemak, kertas hidrofobik yang disediakan khas digunakan. Asid lemak yang lebih tinggi adalah bahan hidrofobik, oleh itu, apabila kromatografi, penggunaan air sebagai fasa pegun dikecualikan. Peranan fasa bergerak biasanya dimainkan oleh asid asetik glasier atau campuran asid asetik dengan asid formik dan air (30: 10: 1).
Tag: palmitik, stearik dan asid lemak tepu lain yang lebih tinggi.
Penyediaan kertas kromatografi. Kertas dibasuh dengan larutan 0.5% asid hidroklorik selama 3 minit, kemudian 5-6 kali dengan air suling, 3 kali dengan etil alkohol dan 4-5 kali dengan dietil eter, kemudian dikeringkan di udara (kerja dijalankan di bawah daya tarikan, dengan lampu dimatikan). alat pemanas, sambil memerhatikan langkah keselamatan kebakaran).
Kertas yang dibasuh dan dikeringkan dipotong menjadi jalur 1-2 cm lebar dan 30-35 cm panjang Satu tepi setiap jalur ditusuk dengan jarum dan benang, membentuk gelung. Untuk hidrofobisasi, jalur diturunkan ke dalam silinder dengan penyumbat tanah, di bahagian bawahnya (lapisan 4-6 cm tinggi) larutan benzena jeli petroleum dituangkan. Gelung benang diletakkan di bawah penyumbat dan bekas itu ditutup rapat. Jalur dikeluarkan apabila larutan mencapai tepi atas kertas (1 cm sebelum gelung), dan keringkan pada suhu bilik(dalam tudung wasap). Apabila merawat dengan minyak tanah, jalur direndam dalam cecair selama 1 minit, kemudian dikeluarkan, ditekan dengan roller di antara dua helai kertas penapis dan dikeringkan dalam kedudukan tergantung pada suhu bilik (dalam hud wasap).
Pengasingan campuran asid lemak. Tambah 2-3 g lemak ke dalam kelalang kon dan tambah 20-25 ml larutan alkohol 25% kalium hidroksida. Kelalang ditutup rapat dengan penyumbat refluks, diletakkan di dalam tab mandi air mendidih dan lemak disabunkan selama 35-40 minit. Masukkan 25-30 ml air panas ke dalam larutan sabun dalam kelalang dan gaul. Penyelesaian dituangkan ke dalam cawan penyejatan dan dipanaskan dalam mandi air panas (suhu air tidak lebih tinggi daripada 85 ° C) sehingga bau alkohol hilang sepenuhnya. Beberapa mililiter larutan asid sulfurik (1:3) ditambah kepada cecair dalam cawan sehingga lapisan asid lemak diasingkan sepenuhnya. Kandungan cawan dituangkan dengan teliti ke dalam corong pemisah. Lapisan asid akueus dipisahkan, dan lapisan asid lemak dibasuh beberapa kali dengan air suam sehingga air basuhan neutral dalam metil oren. Lapisan asid lemak yang telah dibasuh ditapis melalui kertas penapis kering ke dalam botol gelap dengan penyumbat tanah dan disimpan di dalam peti sejuk.
Untuk kromatografi, sediakan larutan asid lemak dalam toluena atau aseton, atau metil alkohol, atau campuran etil alkohol dan dietil eter. Sediakan larutan paip secara berasingan (dalam pelarut yang sama). Kepekatan asid dalam larutan dipilih supaya titisan yang digunakan dengan mikropipet ke atas kertas mengandungi 10-25 μg setiap asid.
Kromatografi. Pada jarak 1-1.5 cm dari tepi bawah jalur kertas dengan grafit
Lukiskan garis lurus dengan pensel, di mana titisan larutan ujian digunakan menggunakan mikropipet. Setitik larutan paip digunakan pada jalur lain yang serupa. Titisan dikeringkan di udara.
Pemisahan dilakukan dalam silinder kaca dengan penyumbat tanah pada suhu bilik. Asid asetik glasier atau campuran asid asetik, asid formik dan air dituangkan ke bahagian bawah silinder. Jalur itu digantung oleh gelung benang, yang diletakkan di bawah gabus supaya pinggir bawah kertas direndam dalam cecair sebanyak 3-5 mm.
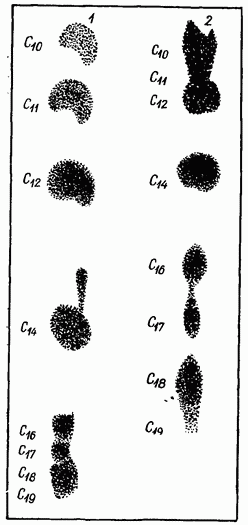
nasi. 12. Kromatogram asid lemak.
Selepas pelarut telah meningkat 26-28 cm di sepanjang kertas, jalur dikeluarkan dan dikeringkan pada suhu bilik, kemudian dibasuh dalam air suling dan dikeringkan semula.
Larutan bismut nitrat asas dituangkan ke dalam mandi fotografi, di mana kromatogram diletakkan selama 10-15 minit, kemudian ia dipindahkan ke mandi lain dengan air suling, yang diubah 10-12 kali. Jalur yang dibasuh dengan baik disembur dengan larutan ammonium sulfhidrat (atau diletakkan di dalam tab mandi dengan larutan): bintik hitam asid lemak muncul (Rajah 12). Kromatogram dicuci 5-6 kali dengan air suling dan dikeringkan di udara. Kira setiap asid
pada kromatogram eksperimen dan kawalan (dengan penanda) dan secara kebetulan tempatnya, komposisi asid lemak ujian ditentukan.
Muka surat 1
Lemak neutral (salah satu subkumpulan lipid) adalah sumber tenaga yang kaya: 1 g lemak membebaskan 9.3 kcal haba semasa pengoksidaan, manakala pada masa yang sama jumlah karbohidrat ini hanya menyediakan 4.2 kcal tenaga. Lemak adalah sebahagian daripada protoplasma sel dan juga melindungi badan daripada penyejukan. Mereka melarutkan vitamin larut lemak. Lemak yang menyelubungi organ dalaman, lindungi mereka daripada kejutan.
Lemak neutral biasanya disaponifikasi dengan alkali kaustik, yang memberikan kadar tindak balas yang mencukupi pada suhu sehingga 100 C.
Lemak neutral ialah ester gliserol dan asid karboksilik; mereka dipanggil gliserida.
Lemak neutral memainkan peranan penting dalam organisma hidup. Mereka adalah sumber tenaga yang kaya: 1 g lemak membebaskan 9 3 kcal haba semasa pengoksidaan; lemak melarutkan vitamin larut lemak. Lemak adalah sebahagian daripada protoplasma sel; mereka adalah bahan nutrien simpanan. Tisu adiposa, menyelubungi organ dalaman, melindungi mereka daripada kejutan. Lemak subkutan melindungi badan daripada penyejukan.
Lemak neutral (trigliserida), termendap dalam kuantiti yang banyak terutamanya dalam vakuol yis dan kulat lain, adalah serupa dengan lemak organisma yang lebih tinggi. Ragi (Candida, Rhodotorula) boleh mengumpul sehingga 80% lemak berhubung dengan bahan kering.
Lemak neutral, atau trigliserida, adalah ester daripada gliserol alkohol trihidrik dan asid lemak yang lebih tinggi.
Lemak neutral, atau trigliserida, adalah ester daripada gliserol alkohol trihidrik dan asid lemak yang lebih tinggi.
Lemak neutral (trigliserida) terdiri daripada tiga molekul asid lemak yang terikat secara kimia kepada satu molekul gliserol IB dalam bentuk ester. Sifat-sifat lemak ditentukan oleh sifat-sifat ischelot lemak yang termasuk dalam komposisinya.
Lemak neutral tidak disuling di bawah vakum yang biasanya digunakan dalam industri - dan walaupun ketika itu suhu tinggi penyulingan mula terurai sebelum mencapai takat didih. Untuk mendapatkan asid lemak didih yang lebih rendah, lemak dihidrolisiskan dengan merawatnya dengan air tiga kali dan dikacau. Molekul lemak, setelah menambahkan tiga molekul air, memecahkan gliserol dan tiga molekul asid lemak. Proses hidrolisis (pemisahan) lemak kepada asid lemak dan gliserol secara teknikal dipanggil (pemisahan atau saponifikasi lemak.
Lipid boleh menjadi mudah atau kompleks. Lemak ringkas terdiri daripada dua komponen (contohnya, lemak neutral mengandungi gliserol dan asid lemak), manakala lemak kompleks mengandungi lebih daripada dua.
Lipid mudah termasuk lemak (trigliserol atau lemak neutral) dan lilin. Komponen penting mereka ialah asid lemak.
Asid lemak (FA) ialah asid monokarboksilik dengan satu rantai alifatik, i.e. terdiri daripada satu kumpulan karboksil dan ekor bukan kutub yang panjang.
Asid lemak dalam lipid semulajadi biasanya mengandungi bilangan atom karbon yang genap
Asid lemak dibahagikan kepada tepu (atau tepu) dan tak tepu (tak tepu). Asid tepu tidak mengandungi ikatan rangkap. Asid tak tepu mengandungi satu (monounsaturated) atau beberapa (politaktepu) ikatan rangkap:
CH 3 (CH 2)nCH=CH(CH2)nCOOH – tak tepu tunggal;
CH 3 (CH 2)n(CH=CHCH 2)m(CH 2)kCOOH – politaktepu
Ikatan berganda dalam asid lemak tak tepu semula jadi diasingkan (tidak terkonjugasi). Sebagai peraturan, ikatan mempunyai konfigurasi cis, yang memberikan ketegaran tambahan kepada molekul tersebut. Ini masuk akal biologi, kerana molekul tersebut adalah sebahagian daripada membran sel.
Mari kita berikan klasifikasi mereka.
FA tak tepu yang paling biasa adalah palmitik dan stearik.
C16:0, singkatan kepada asid palmitik, bermakna ia mempunyai 16 atom karbon dan tiada ikatan berganda.
CH 3 (CH 2) 14 COOH - satu lagi sebutan untuk asid palmitik
C 18:0 – stearik, CH 3 (CH 2) 16 COOH
Di samping itu, asid lemak tepu berikut dikeluarkan:
Dari 12:0 - laurik;
Dari 14:0 – miris;
Dari 20:0 - arachine;
Dari 22:0 – behenovaya;
C 24:0 – lignoserik.
Monoena:
C 16: 1 – palmitooleik
CH 3 (CH 2) 5 CH=CH (CH 2) 7 COOH;
C 18:1 – oleik
CH 3 (CH 2) 7 CH=CH (CH 2) 7 COOH.
Kedudukan ikatan berganda relatif kepada kumpulan karboksil ditunjukkan oleh tanda ∆ 9, di mana nombor itu menunjukkan nombor atom atom karbon yang berdekatan dengan ikatan berganda itu. Oleh itu, asid yang dinamakan boleh dinamakan C 16:1, ∆ 9 dan C 18:1, ∆ 9, masing-masing.
Asid polienoik selalunya mereka mempunyai dua dan tiga ikatan rangkap:
C 18:2, ∆ 9 – linoleik, CH 3 (CH 2) 4 (CH=CHCH 2) 2 (CH 2) 6 COOH;
C 18:3, ∆ 9 – linolenik, CH 3 CH 2 (CH=CHCH 2) 3 (CH 2) 6 COOH.
Kadang-kadang terdapat asid lemak (yang dipanggil luar biasa), dalam rantai alifatik yang terdapat substituen: CH 3 -, -OH, C=O, dll.:
CH 3 (CH 2) 7 -CH-(CH 2) 8 COOH - tuberkulostearik, C 19:0, daripada basil tubercle
CH 3 (CH 2) 5 -CH - CH (CH 2) 9 COOH - lactobacillus C 19:0.
Asid lemak tidak larut dalam air; takat lebur berkurangan dengan peningkatan bilangan ikatan berganda dan pemendekan rantai.
Asid lemak seperti linoleik, linolenik dan seumpamanya (dengan dua dan tiga ikatan berganda) tidak disintesis di dalam badan manusia dan dipanggil penting. Oleh itu, mereka mesti diperoleh daripada makanan.
Dalam kes ini, asid polienoik dibahagikan kepada dua kumpulan: ω-3 dan ω-6 (bergantung kepada kedudukan ikatan berganda daripada atom karbon kumpulan metil terakhir). Asid ini adalah prekursor pelbagai kumpulan hormon tempatan - eicosanoids. Oleh itu, asid linoleik ialah contoh asid ω-6. Contoh asid ω-3 ialah asid timnodonik (eicosapentanoic), C 20:5 (ω-3). Ia ditemui dalam lemak ikan laut, walaupun ia berasal dari tumbuhan dan disintesis oleh fitoplankton. Di samping itu, ikan seperti salmon, makarel, herring, sardin, dan lain-lain, apabila makan plankton, mengumpul asid ini dalam lemak mereka. Apabila seseorang mengambil asid ini, pembekuan darahnya berkurangan, yang digunakan untuk mencegah penyakit kardiovaskular.
lilin
Lilin ialah ester yang dibentuk oleh asid lemak rantai panjang dan alkohol rantai panjang (dengan 16 hingga 36 atom karbon). Lilin diedarkan secara meluas dalam alam semula jadi. Salutan lilin daun dan buah tumbuhan melindungi mereka daripada kerosakan mekanikal, mengurangkan kehilangan lembapan, dan mencegah jangkitan. Dalam vertebrata, lilin yang dirembeskan oleh kelenjar kulit bertindak sebagai salutan pelindung, melincirkan dan melembutkan kulit serta melindunginya daripada air. Rambut ditutup dengan rembesan lilin. Bulu burung dan kulit haiwan juga mempunyai salutan berlilin yang memberikan sifat kalis air. Lilin bulu domba - lanolin - digunakan secara meluas dalam perubatan dan kosmetik sebagai asas untuk penyediaan salap dan krim. Lilin yang dihasilkan oleh lebah berfungsi sebagai bahan binaan untuk sarang lebah:
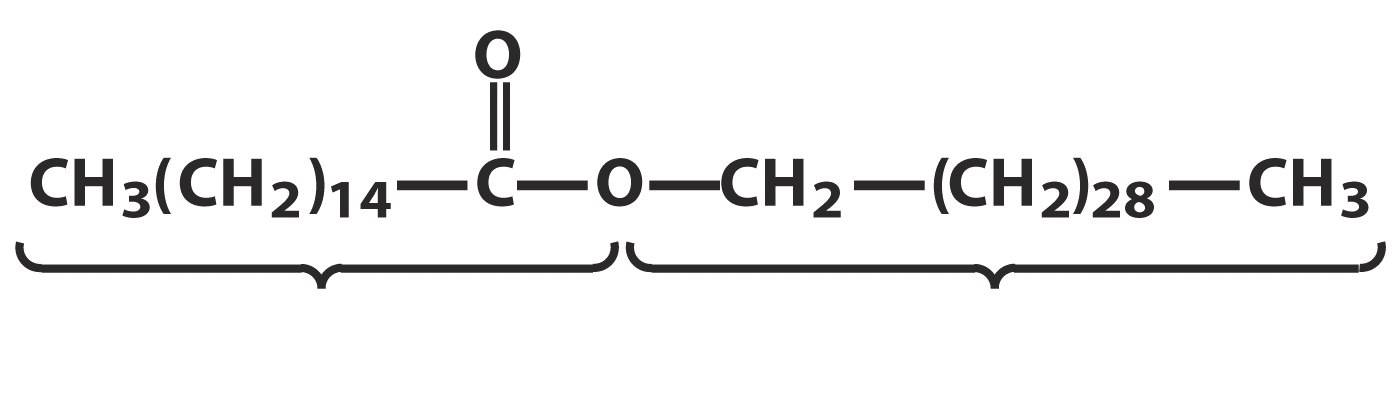
Lilin lebah
Lilin adalah metabolit normal beberapa mikroorganisma. Lilin semulajadi, bersama-sama dengan ester asid lemak yang lebih tinggi dan alkohol yang lebih tinggi, mengandungi sejumlah asid lemak bebas, alkohol, serta hidrokarbon dengan bilangan atom karbon yang ganjil (21-35), pewarna dan bahan wangi. Semua lilin adalah bahan pepejal pelbagai warna, tahan cahaya, agen pengoksidaan, dan haba. Takat leburnya ialah dari 30 hingga 90 o C.
Lemak neutral (triasilgliserol, trigliserida)
Ini adalah ester gliserol dan asid lemak. Lemak neutral boleh menjadi mudah atau bercampur. Yang ringkas mengandungi sisa asid lemak yang sama, yang bercampur mengandungi sisa asid lemak yang berbeza. Lemak neutral boleh mengandungi kedua-dua asid lemak tepu dan tak tepu.
Lemak neutral dibahagikan kepada triasilgliserida, diasilgliserida dan monoasilgliserida (bergantung kepada jumlah asid lemak yang melekat pada gliserol). Yang paling biasa ialah triasilgliserida. Nama triasilgliserol berasal daripada nama asid lemak yang membentuknya. Sebagai contoh, triasilgliserol yang mengandungi tiga residu asid palmitik akan dipanggil tripalmitin:

Jika molekul mengandungi sisa-sisa pelbagai asid lemak, maka namanya akan menunjukkan semua sisa yang termasuk dalam komposisinya dengan pengakhiran –minyak dan penambahan perkataan gliserol. Contohnya, 1-stearoyl, 2-linoleoyl, 3-palmitoyl gliserol:
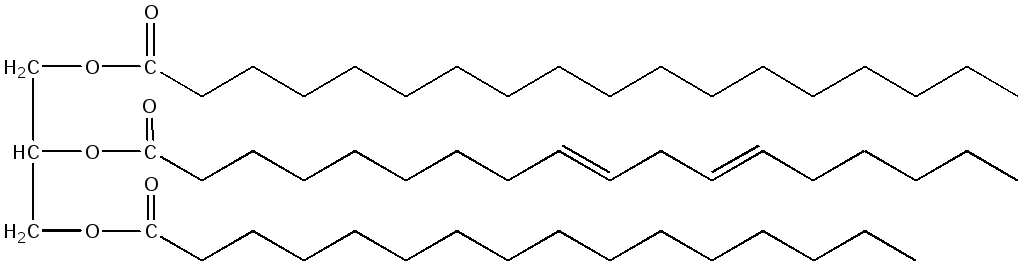
Sifat fizikokimia trigliserida ditentukan oleh sifat asid lemak penyusunnya. Secara amnya, triasilgliserida haiwan mengandungi lebih banyak asid tepu daripada triasilgliserida tumbuhan dan oleh itu lebih keras. Komposisi dan kualiti lemak dicirikan oleh parameter khas yang dipanggil pemalar kimia trigliserida:
1) Nilai iodin ialah bilangan gram iodin yang diikat oleh 100 gram lemak. Oleh kerana iodin mengikat hanya kepada ikatan berganda asid lemak, nilai iodin mencirikan tahap ketidaktepuan lemak.
2) nombor asid - bilangan miligram kalium hidroksida yang diperlukan untuk meneutralkan 1 gram lemak. Menunjukkan jumlah asid lemak bebas dalam lemak.
3) nombor saponifikasi - bilangan miligram kalium hidroksida yang diperlukan untuk meneutralkan semua asid lemak, bebas dan terikat, termasuk dalam lemak.
Molekul fosfolipid dan glikolipid adalah amphiphilic, iaitu, radikal hidrokarbon asid lemak dan sphingosine adalah hidrofobik, dan bahagian molekul yang lain, terbentuk daripada karbohidrat, residu asid fosforik dengan kolin, serin, etanolamin yang melekat padanya, adalah. hidrofilik. Akibat daripada ini, dalam persekitaran akuatik kawasan hidrofobik molekul fosfolipid dialihkan daripada persekitaran akueus dan berinteraksi antara satu sama lain, dan kawasan hidrofilik bersentuhan dengan air, mengakibatkan pembentukan lapisan lipid berganda membran sel (Rajah 9.1.). ini lapisan berganda Membran diserap dengan molekul protein - mikrotubulus. Oligosakarida melekat pada bahagian luar membran. Jumlah protein dan karbohidrat dalam membran yang berbeza tidak sama. Protein membran boleh melakukan fungsi struktur, boleh menjadi enzim, menjalankan pengangkutan transmembran nutrien, dan boleh melakukan pelbagai fungsi pengawalseliaan. Membran sentiasa wujud dalam bentuk struktur tertutup (lihat Rajah 9.1). Lipid dwilapisan mempunyai keupayaan untuk memasang sendiri. Keupayaan membran ini digunakan untuk mencipta vesikel lipid buatan - liposom.
Liposom digunakan secara meluas sebagai kapsul untuk penghantaran pelbagai ubat, antigen, enzim ke pelbagai organ dan tisu, kerana kapsul lipid dapat menembusi membran sel. Ini membolehkan ubat diarahkan tepat ke organ yang terjejas.
Rajah 9.1. Gambar rajah membran sel yang diperbuat daripada dwilapisan lipid. Kawasan hidrofobik molekul lipid menarik antara satu sama lain; Kawasan hidrofilik molekul terletak di luar. Molekul protein menembusi dwilapisan lipid.
Metabolisme lipid
Di dalam badan, lemak neutral terdapat dalam 2 bentuk: lemak simpanan dan lemak protoplasma.
Komposisi lemak protoplasma termasuk fosfolipid dan lipoprotein. Mereka mengambil bahagian dalam pembentukan komponen struktur sel. Membran sel, mitokondria dan mikrosom terdiri daripada lipoprotein dan mengawal kebolehtelapan bahan individu. Jumlah lemak protoplasma adalah stabil dan tidak berubah bergantung pada puasa atau obesiti.
Lemak simpanan (rizab) - ia terdiri daripada triasilgliserol asid lemak - terletak dalam tisu lemak subkutan dan dalam depot lemak organ dalaman.
Fungsi lemak simpanan ialah ia merupakan sumber rizab tenaga yang tersedia untuk digunakan semasa tempoh berpuasa; Ini adalah bahan penebat terhadap kecederaan sejuk dan mekanikal.
Ia juga penting bahawa lipid, apabila mengurai, membebaskan bukan sahaja tenaga, tetapi juga sejumlah besar air:
Apabila 1 gram protein teroksida, 0.4 g dibebaskan; karbohidrat - 0.5 g; lipid - 1 g air. Sifat lipid ini sangat penting untuk haiwan yang hidup dalam keadaan padang pasir (unta).
Pencernaan lipid dalam saluran gastrousus
Dalam rongga mulut, lipid hanya tertakluk kepada pemprosesan mekanikal. Perut mengandungi sejumlah kecil lipase, yang menghidrolisis lemak. Aktiviti rendah lipase jus gastrik dikaitkan dengan tindak balas berasid kandungan perut. Di samping itu, lipase hanya boleh menjejaskan lemak teremulsi; tiada syarat dalam perut untuk pembentukan emulsi lemak. Hanya pada kanak-kanak dan haiwan monogastrik, lipase jus gastrik memainkan peranan peranan penting dalam pencernaan lipid.
Usus adalah tapak utama pencernaan lipid. Dalam duodenum, lipid dipengaruhi oleh hempedu hati dan jus pankreas, dan pada masa yang sama peneutralan kandungan usus (chyme) berlaku. Pengemulsi lemak berlaku di bawah pengaruh asid hempedu. Komposisi hempedu termasuk: asid cholic, deoxycholic (3.12 dihydroxycholanic), chenodeoxycholic (3.7 dihydroxycholanic) asid, garam natrium asid hempedu berpasangan: glycocholic, glycodeoxycholic, taurocholic, taurodeoxycholic. Mereka terdiri daripada dua komponen: asid kolik dan deoksikolik, serta glisin dan taurin.

asid deoksikolik asid chenodeoksikolik
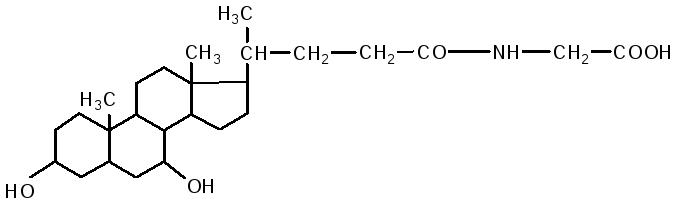
asid glikokol
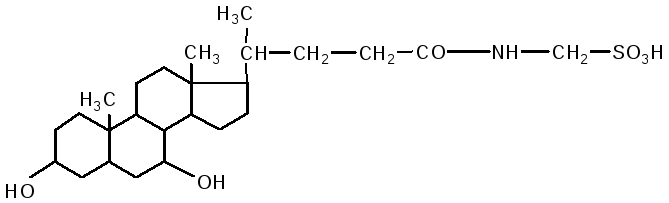
asid taurocholic
Garam hempedu mengemulsi lemak dengan baik. Ini meningkatkan kawasan hubungan antara enzim dan lemak dan meningkatkan kesan enzim. Sintesis asid hempedu yang tidak mencukupi atau pengambilan tertunda menjejaskan keberkesanan tindakan enzim. Lemak, sebagai peraturan, diserap selepas hidrolisis, tetapi beberapa lemak yang diemulsi halus diserap melalui dinding usus dan masuk ke dalam limfa tanpa hidrolisis.
Esterases memecahkan ikatan ester dalam lemak antara kumpulan alkohol dan kumpulan karboksil asid karboksilik dan asid tak organik (lipase, fosfatase).
Di bawah tindakan lipase, lemak dihidrolisiskan menjadi gliserol dan asid lemak yang lebih tinggi. Aktiviti lipase meningkat di bawah pengaruh hempedu, i.e. hempedu secara langsung mengaktifkan lipase. Di samping itu, aktiviti lipase meningkat oleh ion Ca ++ kerana fakta bahawa ion Ca ++ terbentuk. garam tidak larut(sabun) dengan asid lemak yang dibebaskan dan menghalang kesan perencatannya terhadap aktiviti lipase.
Di bawah tindakan lipase, ikatan ester pada atom karbon α dan α 1 (sisi) gliserol mula-mula dihidrolisis, kemudian pada atom β-karbon:
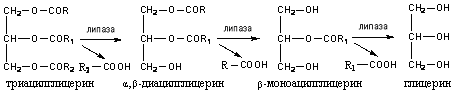
Di bawah tindakan lipase, sehingga 40% triasilgliserida dipecahkan kepada gliserol dan asid lemak, 50-55% dihidrolisiskan kepada 2-monoasilgliserol dan 3-10% tidak dihidrolisis dan diserap dalam bentuk triasilgliserol.
Steride suapan dipecahkan oleh enzim kolesterol esterase kepada kolesterol dan asid lemak yang lebih tinggi. Fosfatida dihidrolisiskan di bawah pengaruh fosfolipase A, A 2, C dan D. Setiap enzim bertindak pada ikatan ester tertentu lipid. Titik penggunaan fosfolipase dibentangkan dalam rajah:
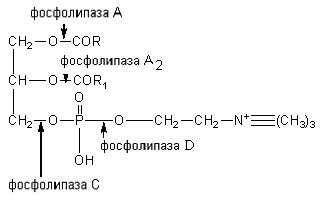
Fosfolipase pankreas, fosfolipase tisu, dihasilkan dalam bentuk proenzim dan diaktifkan oleh trypsin. Racun ular fosfolipase A 2 memangkinkan pembelahan asid lemak tak tepu pada kedudukan 2 fosfogliserida. Dalam kes ini, lysolecithins dengan kesan hemolitik terbentuk.
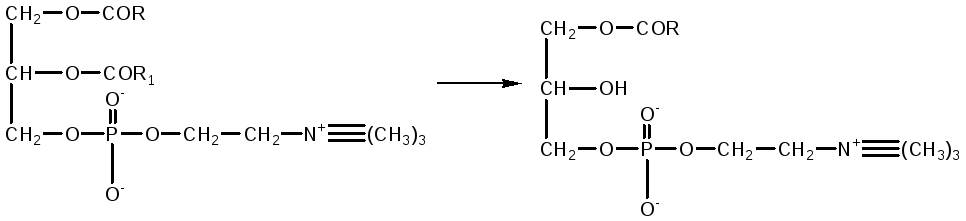
phosphotidylcholine lysolecithin
Oleh itu, apabila racun ini memasuki darah, hemolisis yang teruk berlaku Di dalam usus, bahaya ini dihapuskan oleh tindakan fosfolipase A 1, yang dengan cepat menyahaktifkan lisophosphatide akibat pembelahan sisa asid lemak tepu daripadanya, menukarnya. menjadi glycerophosphocholine yang tidak aktif.
Lysolecithins dalam kepekatan kecil merangsang pembezaan sel limfoid, aktiviti protein kinase C, dan meningkatkan percambahan sel.
Fosfatida kolamin dan fosfatida serin dibelah oleh fosfolipase A kepada fosfatida lisokolamin, fosfatida lisoserin, yang dibelah lagi oleh fosfolipase A 2 . Fosfolipase C dan D menghidrolisis ikatan kolin; kolamin dan serin dengan asid fosforik dan baki asid fosforik dengan gliserol.
Penyerapan lipid berlaku dalam usus kecil. Asid lemak dengan panjang rantai kurang daripada 10 atom karbon diserap dalam bentuk tidak tersterifikasi. Penyerapan memerlukan kehadiran bahan pengemulsi - asid hempedu dan hempedu.
Sintesis semula ciri-ciri lemak organisma tertentu berlaku di dinding usus. Kepekatan lipid dalam darah adalah tinggi dalam masa 3-5 jam selepas makan makanan. Kilomikron– zarah-zarah kecil lemak yang terbentuk selepas penyerapan dalam dinding usus adalah lipoprotein, dikelilingi oleh fosfolipid dan cangkang protein, yang mengandungi molekul lemak dan asid hempedu di dalamnya. Mereka memasuki hati, di mana lipid menjalani metabolisme perantaraan, dan asid hempedu masuk pundi hempedu dan kemudian kembali ke usus (lihat Rajah 9.3 pada ms 192). Akibat daripada peredaran ini, sejumlah kecil asid hempedu hilang. Adalah dipercayai bahawa molekul asid hempedu melengkapkan 4 kitaran setiap hari.

 Pintu masuk
Pintu masuk